Atom
| Atom helijuma | ||||||||
|---|---|---|---|---|---|---|---|---|
 | ||||||||
| Ilustracija atoma helijuma. Prikazan je nukleus (ljubičasto) i distribucija elektronskog oblaka (crno). Nukleus (gore desno) u helijumu-4 je u realnosti sferno simetričan i blisko je sličan elektronskom oblaku, mada kod komplikovanijih nukleusa to nije slučaj. Crna linja predstavlja jedan angstrom (10−10 m ili 100 pm). | ||||||||
| Klasifikacija | ||||||||
| ||||||||
| Svojstva | ||||||||
|
Atom je najmanja gradivna čestica obične materije koja zadržava osobine nekog hemijskog elementa. Svako čvrsto tijelo, tečnost, plin i plazma sastavljeni su iz neutralnih ili ioniziranih atoma. Atomi su veličinom ekstremno mali, obično se njihova veličina kreće oko 100 pikometara (deset-milijarditi dio metra).
Atomi su dovoljno mali tako da pokušaji da se pretpostavi njihovo ponašanje korištenjem postulata klasične fizike, naprimjer prikazujući ih u obliku bilijarskih kugli i slično, daju izrazito netačna predviđanja i rezultate, a uzrok toga su kvantni efekti. Tokom razvoja teoretske atomske fizike, u modele atoma uključeni su kvantni principi za bolje objašnjavanje i predviđanje ponašanja atoma.
Svaki atom sastavljen je iz atomskog jezgra i jednog ili više elektrona vezanih za to jezgro. Atomsko jezgro sastavljeno je iz jednog ili više protona i često istog ili približno istog broja neutrona. Protoni i neutroni nazivaju se i nukleoni. Više od 99,94% mase atoma otpada na njegovo jezgro. Protoni imaju pozitivan električni naboj, elektroni negativan naboj, dok neutroni nemaju električnog naboja. Ako u atomu postoji jednak broj protona i elektrona, takav atom je električno neutralan. Ako atom ima više ili manje elektrona od protona, tada je on općenitno negativno ili pozitivno naelektrisan, te se naziva ion. Elektromagnetna sila privlači elektrone protonima u atomskoj jezgri. Unutar jezgre, protoni i neutroni se međusobno privlače nuklearnim silama, koja je obično mnogo snažnija od elektromagnetnih sila koji odbija pozitivno naelektrisane protone jedne od drugih. Pod određenim okolnostima, odbijajuća elektromagnetna sila postane jača od nuklearnih sila, te se nukleoni izbacuju iz jezgra, a atom tog elementa pretvara se u atom drugog elementa, što predstavlja nuklearni raspad, čiji je krajnji rezultat nuklearna transmutacija.
Broj protona u jezgru definira kojem hemijskom elementu taj atom pripada; naprimjer, svi atomi bakra imaju 29 protona. Broj neutrona u jezgru definira izotop tog elementa. Broj elektrona utječe na elektromagnetske osobine atoma. Atom se može spojiti sa jednim ili više drugih atoma putem hemijskih veza gradeći hemijske spojeve u vidu molekula. Sposobnost atoma da se međusobno spajaju i razdvajaju odgovorna je za većinu fizičkih promjena koje se mogu zapaziti u prirodi i predmet je izučavanja hemijskih nauka.
Historija atomske teorije[uredi | uredi kod]
U filozofiji[uredi | uredi kod]
Ideja da je sva materija sastavljena iz sitnih čestica je vrlo stara ideja, koja se pojavljuje u mnogim drevnim kulturama poput grčke i indijske. Riječ "atom" (grčki: ἄτομος, atomos), što znači "nedjeljiv", "koji se ne može rezati", prvi je spomenuo antički grčki filozof Leukip i njegov učenik Demokrit.[1][2][3][4] Demokrit je smatrao da je broj atoma beskonačan, da ne mogu nastati niti nestati, da su vječni te da su osobine nekog predmeta rezultat toga od koje vrste atoma je sastavljen.[2][3][4] Demokritov atomizam razradio je i usavršio kasniji filozof Epikur.[3][4]
Tokom ranog Srednjeg vijeka, na atomizam se gotovo zaboravilo u zapadnoevropskoj filozofiji, ali je "preživio" u radovima nekih islamskih filozofa.[3] Tokom 12. vijeka, u zapadnoj Evropi ponovno se javljaju ideje atomizma, koga su tadašnji evropski filozofi spoznali kroz iznova "otkrivene" Aristotelove radove.[3] U 14. vijeku, ponovna "otkrića" velikih dijela antičkih atomista, uključujući djela Lukrecija De rerum natura i Diogena Laertija Životi i mišljenja eminentnih filozofa, dovela su do povećanja interesovanja za ovu temu.[3] Ipak, pošto je atomizam bio vezan sa filozofijom Epikura, što je bilo u suprotnosti sa ortodoksnim kršćanskim učenjem, vjerovanje u postojanje atoma nije bilo prihvatljivo.[3] Francuski katolički sveštenik Pierre Gassendi (1592–1655) oživio je Epikurov atomizam uz određena prilagođavanja, tako da je tvrdio da je atome kreirao Bog, pa iako ih ima u nezamislivo ogromnom broju, taj broj nije beskonačan.[3][4] Gassendijeva izmijenjena atomska teorija bila je široko prihvaćena u Francuskoj, a zagovarao ju je i fizičar François Bernier (1620–1688), kao i u Engleskoj gdje se njome bavio filozof Walter Charleton (1619–1707).[3] Hemičar Robert Boyle i fizičar Isaac Newton (1642–1727) branili su postulate atomizma te je on krajem 17. vijeka postao prihvaćena teorija u naučnim krugovima.[3]
Teorije na osnovu dokaza[uredi | uredi kod]
Početkom 19. vijeka, John Dalton je koristio koncept atoma u objašnjavanju teorija zašto elementi uvijek reagiraju u odnosima malih cijelih brojeva (zakon višestrukih proporcija). Naprimjer, postoje dvije vrste oksida kalaja: jedan sa 88,1% kalaja i 11,9% kisika a drugi sa 78,7% kalaja i 21,3% kisika (kalaj(II)-oksid i kalaj-dioksid). To znači da se 100 grama kalaja može spojiti sa 13,5 g ili 27 g kisika. Odnos 13,5 i 27 stoji u proporciji 1:2, tj. proporciji malih cijelih brojeva. Ova općenita šema u hemiji dala je ideju Daltonu da elementi reagiraju višestrukim konačnim jednicama, drugim riječima, atomima. U navedenom primjeru oksida kalaja, jedan atom kalaja spaja se bilo sa jednim ili sa dva atoma kisika.[5]
Dalton je također vjerovao da atomska teorija može objasniti zašto voda apsorbira različite plinove u različitim proporcijama. Naprimjer, on je otkrio da voda apsorbira ugljik-dioksid mnogo bolje nego što apsorbira dušik.[6] Dalton je pretpostavio da je razlog tome razlika između masa i konfiguracija čestica plina, jer su molekule ugljik-dioksida (CO2) teže i veće od molekula dušika (N2).
Brownovo kretanje[uredi | uredi kod]
Godine 1827, botaničar Robert Brown je pomoću mikroskopa posmatrao čestice prašine koje su plutale u vodi i otkrio da su one kretale haotično i bez reda, a taj fenomen je kasnije nazvan "Brownovo kretanje". U to vrijeme smatralo se da molekule vode udaraju u čestice prašine i tako ih pomjeraju. Godine 1905. Albert Einstein je dokazao stvarnost ovih molekula i njihovog kretanja praveći prvu statističku fizikalnu analizu Brownovog kretanja.[7][8][9] Na osnovu Einsteinovog rada, francuski fizičar Jean Perrin je eksperimentalno odredio masu i dimenzije atoma, te time nedvosmisleno dokazao Daltonovu atomsku teoriju.[10]
Otkriće elektrona[uredi | uredi kod]
Fizičar J.J. Thomson je mjerio masu katodnih zraka, te dokazao da su one sastavljene iz čestica, ali su one bile oko 1800 puta lakše od najlakšeg poznatog atoma, vodika. Iz toga je zaključeno da to nisu bili atomi nego nove čestice, odnosno prve otkrivene subatomske čestice koje su najprije nazvane korpuskule, da bi kasnije dobile ime elektroni, prema nazivu kojeg je predložio George Johnstone Stoney u svojim radovima iz 1874. godine. Thomson je također dokazao da su to identične čestice onima koje emitiraju fotoelektrični i radioaktivni materijali.[11] Vrlo brzo došlo se do shvatanja da su to čestice koje "prenose" električnu struju u metalnim provodnicima, te unutar atoma nose negativni električni naboj. Thomsonu je 1906. godine za svoj rad dodijeljena Nobelova nagrada za fiziku. Time je on oborio vjerovanje su atomi nedjeljive, gradivne čestice materije.[12] Međutim, Thomson je postavio pogrešnu teoriju da su negativno naelektrisani elektroni, vrlo male mase, ravnomjerno raspoređeni po atomu kao jednolični sloj negativnog naelektrisanja. Ovaj model atoma postao je poznat pod nazivom "model pudinga od šljiva".
Otkriće atomske jezgre[uredi | uredi kod]
Godine 1909. Hans Geiger i Ernest Marsden, prema savjetima Ernesta Rutherforda, izvršili su eksperiment bombardiranja metalne folije alfa česticama i mjerili kako se one ponašaju pri sudaru s njom. Prema njihovim pretpostavkama, sve alfa čestice trebale su proći ravno kroz foliju uz nimalo ili vrlo malo rasipanje ili odbijanje, jer je Thomsonov model atoma pretpostavljao da su naelektrisanja u atomu toliko raštrkana da njihova električna polja ne mogu mnogo utjecati na alfa čestice. Međutim, Geiger i Mardsen su uočili da su se neke alfa čestice odbijale od atoma pod uglovima većim od 90°, za šta Thomsonov model nije mogao pružiti nikakvo objašnjenje. Da bi takvu pojavu objasnio, Rutherford je postavio teoriju da su pozitivna naelektrisanja u atomu koncentrirana u malom jezgru u središtu atoma.[13]
Otkriće izotopa[uredi | uredi kod]
Dok je eksperimentirao sa proizvodima radioaktivnog raspada 1913. godine, hemičar Frederick Soddy otkrio je da se u periodnom sistemu javlja više od jedne vrste atoma na svakom mjestu u PSE.[14] Pojam izotop skovala je Margaret Todd kao pogodno ime za različite vrste atoma koji pripadaju istom hemijskom elementu. J.J. Thomson izumio je tehniku separacije izotopa tokom svog rada na proučavanju ioniziranih plinova, što je u konačnici dovelo do otkrića stabilnih izotopa.[15]
Bohrov model[uredi | uredi kod]

Godine 1913. fizičar Niels Bohr predložio je model atoma u kojem njegovi elektroni orbitiraju oko jezgra, ali po strogo određenom broju orbita, te da mogu prelaziti između orbita samo uz tačno određenu promjenu energije koja odgovara apsorpciji ili emitiraju fotona.[16] Ova kvantizacija se koristila za objašnjavanje zašto su orbite elektrona stabilne (tj. da nema promjena u ubrzanju njihovog kretanja, uključujući kružno kretanje i gubitak kinetičke energije koja se emitira kao elektromagnetno zračenje) i zašto hemijski elementi apsorbiraju i emitiraju elektromagnetno zračenje u tačno određenom spektru.[17]
Kasnije iste godine Henry Moseley dao je dodatne eksperimentalne dokaze koji su podržali Bohrovu teoriju. Ove rezultate poboljšali su Rutherfordov i Van den Broekov model atoma, koji su predviđali da atom u svom jezgru sadrži određen broj pozitivnih nuklearnih naboja koji su jednaki atomskom broju tog elementa u periodnom sistemu. U vremenu prije tih eksperimenata, za atomski broj se nije smatralo da je fizička ili eksperimentalna količina. Činjenica da nuklearni naboj atoma odgovara atomskom broj, ostala je važeća i kod današnjih teorija modela atoma.[18]
Teorija hemijskih veza[uredi | uredi kod]
Godine 1916. Gilbert Newton Lewis postavio je teoriju o hemijskim vezama između atoma, prema kojoj su one zapravo interakcije između elektrona u tim atomima.[19] Pošto su hemijske osobine elemenata većinom bile poznate i da su se one pretežno ponavljale u skladu periodičnih zakona,[20] tako je 1919. američki hemičar Irving Langmuir postavio teoriju da bi se taj pojava mogla objasniti ako su elektroni u atomu povezani ili na neki način grupisani. Takve grupe elektrona koje "zauzimaju" tačno određeno područje oko jezgra nazvane su elektronske ljuske.[21]
Razvoj kvantne fizike[uredi | uredi kod]
Stern–Gerlachov eksperiment iz 1922. dao je daljnje dokaze o kvantnoj prirodi atomskih osobina. Tokom tog eksperimenta, snop atoma srebra usmjeren je kroz posebno oblikovano magnetno polje, te se on razdvojio na način koji odgovara smjeru ugaonog momenta atoma odnosno spinu. Kako je smjer spina isprva bio nasumičan, očekivalo se da će se snop odbiti u nasumičnom smjeru. Umjesto toga, snop se razdvojio u dvije usmjerene komponente koje odgovaraju stanju da li je atomski spin usmjeren prema dolje ili gore u odnosu na magnetno polje.[22]
Godine 1925. Werner Heisenberg je objavio prvu konzistentnu matematičku formulaciju kvantne mehanike (matrična kvantna mehanika).[18] Godinu ranije, 1924, Louis de Broglie je postavio teoriju da se sve čestice ponašaju i kreću u obliku talasa, pa je tako 1926. Erwin Schrödinger upotrijebio tu ideju za razvoj matematičkog modela atoma (talasna mehanika) kojim je opisao elektrone u obliku trodimenzionalnog talasa umjesto kao do tada u obliku tačkaste čestice.
Kao posljedica postojanja talasnog oblika kojim se opisuju čestice, matematički je nemoguće dobiti neke tačne vrijednosti ni za geometrijsku poziciju ni za moment čestice u bilo kojem vremenskom trenutku. Taj princip postao je poznat kao princip neodređenosti a formulirao ga je Werner Heisenberg 1927. godine.[18] Prema tom konceptu, uz određenu tačnost pri mjerenju mjesta nekog elektrona moguće je dobiti samo raspon mogućih vrijednosti momenta i obrnuto.[23] Takav model mogao je objasniti mjerenja i posmatranja atomskih osobina što prethodni modeli nisu mogli, poput određenih strukturnih i spektralnih osobina atoma težih od vodika. Prema tome, planetarni modeli atoma su prevaziđeni modelom koji je opisao moguće zone atomskih orbitala oko jezgra gdje postoji najveća vjerovatnoća da bi se određeni elektron mogao nalaziti u određenom vremenu.[24][25]
Otkriće neutrona[uredi | uredi kod]
Otkriće masene spektrometrije omogućilo je mjerenje mase atoma mnogo preciznije nego što je to bilo ranije moguće. Uređaj je koristio magnet koji je služio za skretanje pravca kretanja snopa iona, te se na osnovu količine odbijanja snopa može odrediti odnos u promjeni masa atoma prije i nakon toga. Hemičar Francis William Aston koristio je ovaj instrument kako bi pokazao da izotopi imaju različite mase. Atomske mase tih izotopa varirale su i razlikovale međusobno u cijelim iznosima, što je nazvano pravilo cijelih brojeva.[26] Objašnjenje tih različitih izotopa čekalo je do otkrića neutrona, nenabijene čestice mase sličnoj protonu, što je 1932. uspjelo fizičaru Jamesu Chadwicku. Na taj način, otkriveno je da su izotopi hemijski elementi sa istim brojem protona, ali različitim brojem neutrona u svom jezgru.[27]
Fisija i novija otkrića[uredi | uredi kod]
Godine 1938, njemački hemičar Otto Hahn, student Ernesta Rutherforda, vršio je eksperiment tako što je usmjerio snop neutrona u atome uranija, očekujući da će dobiti neki transuranijski element. Umjesto toga, rezultati njegovog eksperimenta pokazali su da je dobio barij.[28][29] Godinu kasnije, Lise Meitner i njen sestrić Otto Robert Frisch potvrdili su Hahnove rezultate kao prvu eksperimentalno izvedenu nuklearnu fisiju.[30][31] Hahn je 1944. za svoje otkriće fisije dobio Nobelovu nagradu za hemiju. Međutim, i pored Hahnovog zalaganja, doprinosi Meitner i Frischa ovom otkriću nisu priznati.[32]
Tokom 1950ih, razvoj naprednih uređaja ubrzivača (akceleratora) čestica i uređaja za njihovu detekciju omogućio je naučnicima izučavanje procesa sudaranja atoma koji se kreću s vrlo visokim kinetičkim energijama.[33] Za neutrone i protone utvrđeno je da su to zapravo hadroni, odnosno sastavljeni iz još manjih čestica nazvanih kvarkovi. Time je razvijen standardni model fizike čestica koji je do danas uspješno predstavio osobine jezgra atoma u smislu da tih subatomskih čestica kao i sila koje određuju njihova međudjelovanja.[34]
Struktura[uredi | uredi kod]
Subatomske čestice[uredi | uredi kod]
Iako je pojam atom prvobitno označavao česticu koja se ne može razbiti u manje čestice, u modernom naučnom žargonu, smatra se da je atom sastavljen iz više subatomskih čestica. Gradivne čestice atoma su elektroni, protoni i neutroni. Sve tri vrste čestice spadaju u fermione. Međutim, atom vodika (izotop H-1) nema neutrona, dok hidron-ion (1H+) nema elektrona.
Elektroni su ubjedljivo najlakše među ovim česticama, mase 9,11×10−31 kg, sa negativnim električnim nabojem i veličine tako male da ga je nemoguće izmjeriti pomoću danas dostupnih tehnika.[35] On je bio najlakša čestica sa pozitivnom masom u mirovanju, sve do otkrića neutrina i određivanja njegove mase. U uobičajenim okolnostima, elektroni su vezani sa pozitivno naelektrisanim jezgrom putem sile privlačenja suprotno naelektrisanog naboja. Ukoliko atom ima jedan više ili manje elektrona od svog atomskog broja, tada postaje negativno ili pozitivno naelektrisan, respektivno, a nabijeni (naelektrisani) atom naziva se ion. Elektroni su otkriveni krajem 19. vijeka, uglavnom zahvaljujući radovima J.J. Thomsona.
Protoni imaju pozitivni naboj i masu 1.836 puta veću od elektron, oko 1,6726×10−27 kg. Broj protona u atomu naziva se atomski broj. Ernest Rutherford (1919) proučavao je dušik i bombardirao ga alfa-česticama, pri čemu je zapazio da dušik pri tom emitira nešto što izgleda kao jezgro vodika. Naredne godine, preformulirao je otkriće tako da je zaključio da je jezgro vodika posebna čestica unutar atoma koju je nazvao proton.
Neutroni nemaju električni naboj te imaju slobodnu masu 1.839 puta veću od mase elektrona ili oko 1,6749×10−27 kg.[36][37] Neutroni su najteži od tri osnovne gradivne čestice atoma, ali se njihova masa može reducirati nuklearnom energijom vezanja. Neutroni i protoni (zajednički nazvani nukleoni) imaju približno iste dimenzije, veličine reda 2,5×10−15 m, mada "površina" ovih čestica nije jasno definirana.[38] Neutrone je 1932. otkrio engleski fizičar James Chadwick.
U standardnom modelu fizike, elektroni su prave elementarne čestice bez unutrašnje strukture. Međutim, i protoni i neutroni su složene čestice sastavljene iz elementarnih čestica nazvanih kvarkovi. Postoji dvije vrste kvarkova u atomu, svaki sa djelimičnim električnim nabojem. Protoni su sastavljeni iz dva gornja kvarka (up-kvark) (svaki sa nabojem +2
3) i jednog donjeg kvarka (sa nabojem -1
3). Neutroni su sastavljeni iz jednog gornjeg i dva donja kvarka. Ova razlika "odgovorna" je i za razliku u masama i nabojima između ove dvije čestice.[39][40] Kvarkovi se drže na okupu djelovanjem jake interakcije (tj. jake sile), koju reguliraju gluoni. Protone i neutrone u jezgru međusobno veže djelovanje nuklearnih sila, koja je "ostatak" jakih sila koje donekle imaju različite osobine u pogledu udaljenosti na kojoj djeluju. Gluoni su članovi porodice baždarnih bozona, koje su elementarne čestice preko kojih se ispoljavaju fizičke sile.[39][40]
Jezgro[uredi | uredi kod]

Svi vezani protoni i neutroni u atomu sačinjavaju relativno malo atomsko jezgro, te se kolektivno nazivaju nukleoni. Prečnik atomskog jezgra približno je jednak 1,07 3√A femtometara, gdje je A ukupni broj nukleona u njemu.[41] To je znatno manje od prečnika cijelog atoma, koji je reda veličine 105 fm. Nukleoni se drže zajedno vezani privlačnim potencijalom koji djeluje na kratkoj udaljenosti, a naziva se rezidualna jaka nuklearna sila. Na udaljenostima kraćim od 2,5 fm ova sila je znatno snažnije od elektrostatičke sile koja uzrokuje da se pozitivno nabijeni protoni odbijaju jedan od drugog.[42]
Atomi istog elementa imaju isti broj protona u jezgru, a taj broj odgovara atomskom broju elementa. Za svaki hemijski element, postoje atomi kod kojih broj neutrona varira, a taj broj određuje izotop tog elementa. Ukupan broj protona i neutrona određuje o kojem nuklidu se radi. Broj neutrona u odnosu na broj protona određuje koliko je to jezgro stabilno, jer se određeni izotopi raspadaju nekim od radioaktivnih načina raspada.[43] Proton, elektron i neutron svrstani su u grupu fermionskih čestica. Za fermione važni Paulijev princip isključenja, koji zabranjuje identičnim fermionima, kao što je više od jednog protona, da zauzimaju isto kvantno stanje u isto vrijeme. Stoga, svaki proton u jezgru mora zauzimati kvantno stanje različito od svih drugih protona, a isti princip se primjenjuje i na sve neutrone u jezgru i sve elektrone u elektronskom oblaku.[44]
Atomska jezgra koja imaju različit broj protona i neutrona imaju potencijal da pređu u niže energetsko stanje putem radioaktivnog raspada čije posljedice se ogledaju u tome da se broj neutrona približi broju protona. Rezultat tog procesa je da nastaju atomi koji imaju podjednak broj protona i neutrona i koji su mnogo "otporniji" na raspad. Ipak, povećanjem atomskog broja, međusobno odbijanje protona zahtijeva povećanje odnosa broja neutrona u odnosu na broj protona kako bi se održavala stabilnost jezgra, što neznatno mijenja ovaj trend jednakog broja protona i neutrona kod atoma sa nižim atomskim brojevima.[44]
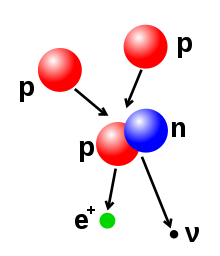

Broj protona i neutrona u atomskom jezgru može se promijeniti, ali je za to potrebna veoma velika energija zbog vrlo snažnih sila koje djeluju unutar jezgra. Nuklearna fuzija se dešava kada se veći broj lakših atomskih čestica međusobno spoje i izgrade teže atomsko jezgro, poput energetskih sudara dva atomska jezgra. Naprimjer, u središtu Sunca protonima je potrebno približno 3–10 keV energije da bi svladali sile njihovog međusobnog odbijanja, te spojili se u jednu atomsko jezgru. Ta energetska granica nazvana je Coulombova barijera.[45] Nuklearna fisija je proces suprotan fuziji, pri kojoj se atomsko jezgro raspada na dva manja jezgra, obično praćeno radioaktivnim raspadom. Jegra se mogu izmijeniti i bombardiranjem subatomskim česticama ili fotonima visoke energije. Ako se u tom procesu promijeni broj protona u jezgru, atom prelazi u drugi hemijski element.[46][47] Ako je masa jezgra nastalog nakon reakcije fuzije manja od masa polaznih čestica koje su učestvovale u reakciji, tada se razlika između ove dvije vrijednosti može emitirati u vidu neke korisne energije (poput gama zraka) ili kinetičke energije u vidu beta čestica, kako je opisano poznatom Einsteinovom formulom ekvivalencije mase i energije, , gdje je razlika u gubitku mase a brzina svjetlosti. Ovaj deficit mase je dio energije vezivanja novonastalog jezgra, i to je nepovratni gubitak energije koji uzrokuje da spojene čestice ostanu zajedno u stanju koje zahtijeva ovu energije da bi se razdvojile.[48]
Fuzija dva jezgra kojom nastaje veće i teže jegro sa atomskim masama manjim od Fe i Ni, gdje je ukupni broj nukleona oko 60, obično je egzotermička reakcija, kojom se otpušta više enegije nego što je potrebno da bi se ona spojila.[49] Ovaj proces kojim se otpušta energija omogućava da se nuklearna fuzija u zvijezdama neprekidno odvija. Kod težih jezgara, energija vezivanja po jednom nukleonu u jezgru počinje opadati. To znači da su procesi fuzije, kojima nastaju atomi atomskih brojeva viših od 26 i atomskim masama višim od 60, endotermičke rekacije. Zbog toga masivnije jezge ne mogu održavati reakcije fuzije kojima nastaje "višak" energije niti mogu održavati hidrostatičku ravnotežu zvijezde.[44]
Elektronski oblak[uredi | uredi kod]
Elektrone u atomu privlače protoni iz njegovog jezgra elektromagnetnim silama. Ove sile vežu elektrone unutar elektrostatičke jame potencijala okružujući malo atomsko jezgro, što znači da je elektronu za "bijeg" iz atoma potreban vanjski izvor energije. Što god je elektron bliži jezgru, veća je njegova privlačna sila. Prema tome, elektroni vezani bliže centru jame potencijala zahtijevaju više energije kako bi bili izbijeni iz atoma, od onih elektrona koji se nalaze dalje od jezgra.
Kao i druge čestice, elektroni imaju i čestične i talasne osobine. Elektronski oblak je područje unutar jame potencijala gdje svaki elektron gradi neku vrstu trodimenzionalnog stacionarnog talasa, tj. oblika talasa koji se ne kreće u odnosu na jezgro. Ovo ponašanje definira atomsku orbitalu u obliku matematičke funkcije koju karakterizira vjerovatnoća da će se elektron nalaziti na određenom položaju u trenutku kada se njegov položaj mjeri.[50] Postoji samo diskretno kvantizirani set takvih orbitala oko atomskog jezgra, jer se druge moguće talasne pozicije vrlo brzo raspadnu na neku od stabilnijih formi.[51] Orbitale mogu imati jednu ili više prstenastih ili tačkastih struktura te se jedna od druge razlikuju u veličini, obliku i usmjerenju (orjentaciji).[52]
Svaka atomska orbitala odgovara određenom nivou energije elektrona. Elektroni mogu promijeniti svoje stanje na viši energetski nivo putem apsorpcije fotona koji nosi dovoljnu količinu energije kojom je moguće pobuditi elektron do novog višeg kvantnog stanja. Na sličan način, putem spontane emisije, elektron na višem energetskom nivou može preći na niži energetski nivo istovremeno emitirajući višak energije u vidu fotona. Takve karakteristične vrijednosti energije, definirane kao razlike između energija određenih kvantnih stanja, odgovorne su za pojavu atomskih spektralnih linija.[51] Iznos energije potrebne da se doda ili ukloni elektron, tj. energije vezivanja elektrona, daleko je manji od energije vezivanja nukleona. Naprimjer, potrebno je "samo" 13,6 eV da se ukloni elektron u osnovnom stanju iz atoma vodika,[53] u odnosu na 2,23 miliona eV potrebnih da bi se razbilo jezgro deuterija.[54] Atomi su u električno neutralnom stanju ako imaju isti broj protona i neutrona. Atomi koji imaju višak ili manjak elektrona nazivaju se ioni. Elektroni koji se nalaze najdalje od jezgra mogu preći na druge susjedne atome ili ih dva atoma mogu dijeliti kao zajedničke. Tim mehanizmom, atomi mogu graditi hemijske veze te se međusobno vezati u molekule i druge vrste hemijskih spojeva poput ionskog i kovalentnog sistema kristala.[55]
Osobine[uredi | uredi kod]
Nuklearne osobine[uredi | uredi kod]
Po definiciji, bilo koja dva atoma sa identičnim brojem protona u njihovim jezgrima, pripadaju istom hemijskom elementu. Atomi sa istim brojem protona, ali različitim brojem neutrona predstavljaju različite izotope istog elementa. Naprimjer, svi atomi vodika imaju po jedan proton u jezgru, ali postoji razni izotopi među kojim je izotop bez neutrona u jezgru (vodik-1, kojeg ima ubjedljivo najviše,[56] zvani protij), sa jednim (deuterij), dva (tricij) ili više neutrona. Svi poznati elementi čine set atomskih brojeva, počev od elementa sa jednim (vodik) do elementa sa 118 protona (oganeson).[57] Svi poznati izotopi elemenata koji imaju atomske brojeve veće od 82 su radioaktivni, mada je radioaktivnost elementa 83 (bizmut) tako slaba da se praktično može smatrati da je nema.[58][59]
Na Zemlji je otkriveno približno 339 nuklida,[60] a kod 254 od njih (oko 75%) nije opažen raspad, te se oni definiraju kao "stabilni izotopi". Ipak, samo 90 tih nuklida su stabilni u odnosu na sve vrste radioaktivnog raspada, čak i u teoriji. Za ostalih 164 (što čini ukupno 254 nuklida) nisu opaženi raspadi, mada je prema njihovoj strukturi u teoriji moguć njihov raspad. Ovi nuklidi se formalno smatraju "stabilnim". Dodatna 34 radioaktivna nuklida imaju vremena poluraspada duža od 80 miliona godina, te su dovoljno dugoživući da bi se na Zemlji mogli nalaziti još iz perioda nastanka Sunčevog sistema. Ova "kolekcija" od 288 nuklida poznati su i kao primordijalni nuklidi. Najzad, poznat je još i 51 kratkoživući nuklid za koje se zna da se prirodno javljaju na Zemlji, kao proizvodi raspada primordijalnih nuklida (poput radija iz uranija) ili neki drugi način u vidu proizvoda prirodnih energetskih procesa na Zemlji, naprimjer bombardiranjem kosmičkih zraka (poput nastanka ugljika-14).[61][note 1]
Od svih hemijskih elemenata, njih 80 ima barem jedan stabilni izotop. Mnogi hemijski elementi imaju nekoliko stabilnih izotopa, prosječno postoji 3,2 stabilna izotopa po svakom hemijskom elementu. Dvadeset šest elemenata ima samo jedan stabilni izotop, dok najveći broj stabilnih izotopa od svih elemenata ima kalaj sa deset stabilnih izotopa. Elementi 43, 61, i svi elementi sa atomskim brojevima 83 i većim nemaju niti jedan stabilan izotop.[62]
Na stabilnost izotopa primarno utiče odnos broja protona i neutrona, ali također i prisustvo određenih "magičnih brojeva" neutrona i protona koji predstavljaju zatvorene i u potpunosti popunjene kvantne ljuske. Te kvantne ljuske odgovaraju i tačno definisanim setovima nivoa energije unutar modela ljusaka jezgra; popunjene ljuske, kao što je naprimjer popunjena ljuska sa 50 protona kod kalaja, daje neuobičajenu stabilnost tom nuklidu. Od 254 poznata stabilna nuklida, samo njih četiri imaju i neparan broj protona i neparan broj neutrona: izotop vodika-2 (deuterij), litij-6, bor-10 i dušik-14. Osim toga, samo četiri nuklida koji se javljaju u prirodi, a koji su radioaktivni, imaju neparne brojeve protona i neutrona u jezgru: kalij-40, vanadij-50, lantan-138 i tantal-180m. Ovi nuklidi imaju vrijeme poluraspada duže od milijardu godina. Većina jezgara sa neparnim brojem i protona i neutrona su veoma nestabilna u odnosu na beta raspad, jer proizvodi raspada imaju parne brojeve i protona i neutrona, pa su stoga mnogo snažnije vezani zbog nuklearnih efekata sparivanja.[62]
Masa[uredi | uredi kod]
Velika većina mase atoma sadržana je u protonima i neutronima u njegovom jezgru. Ukupan broj ovih čestica (nazvanih "nukleoni") u nekom atomu naziva se maseni broj. To je pozitivan, cijeli broj, bez jedinice mjere (iako ima masenu dimenziju) jer označava broj čestica. Primjer korištenja masenog broja je ugljik-12, što znači da u jezgru ovog izotopa ima 12 nukleona (šest protona i šest neutrona).
Stvarna masa atoma u mirovanju često se izražava pomoću unificirane jedinice atomske mase (u), također zvane i dalton (Da). Ova jedinica definirana je kao dvanaestina mase slobodnog neutralnog atoma izotopa ugljika-12, a približno izraženo u kilogramima ona iznosi 1,66×10−27 kg.[63] Vodik-1 (protij) (najlakši izotop vodika, a također i nuklid sa najnižom masom) ima atomsku težinu 1,007825 u.[64] Vrijednost ovog broja naziva se atomska masa. Određeni atom ima atomsku masu koja je približno jednaka (uz razliku do 1%) njegovom masenom broju pomnoženom sa jedinicom atomske mase (naprimjer masa atoma dušika-14 je približno 14 u). Međutim, ovaj broj neće uvijek biti cijeli broj osim kod ugljika-12.[65] Najteži stabilni atom, olovo-208,[58] ima masu 207,9766521 u.[66]
Pošto su i najteži atomi isuviše lahki da bi se s njima moglo direktno raditi i mjeriti, hemičari dogovorno upotrebljavaju jedinicu mol. Jedan atoma (ili bilo kojih drugih čestica) bilo kojeg elementa uvijek ima isti broj atoma (čestica), oko 6,022×1023. Taj broj naziva se Avogadrova konstanta. On je odabran tako da ako element ima atomsku masu 1 u, jedan mol tog elementa imat će masu približno jedan gram. Zbog definicije unificirane jedinice atomske mase, svaki atom ugljika-12 ima atomsku masu tačno 12 u, pa jedan mol atoma ugljika-12 ima masu tačno 0,012 kg.[63]
Oblik i veličina[uredi | uredi kod]
Atomima nedostaje strogo definirana vanjska granica, pa se njihove dimenzije obično opisivaju pojmom atomskog radijusa. On mjeri razdaljinu koliko se elektronski oblak udaljava od jezgra.[67] Međutim, time se eksplicitno pretpostavlja da atom ima loptast oblik, što je moguće ako se atomi posmatraju u vakuumu ili slobodnom prostoru. Atomski radijusi se mogu izračunati iz udaljenosti između dva jezgra u slučaju kada se dva atoma spoje pomoću neke od hemijskih veza. Radijusi su dosta varijabilni u zavisnosti od položaja atoma u periodnom sistemu, vrste hemijske veze koju grade sa drugim atomima, broja susjednih atoma (koordinacijski broj) i kvantno-mehaničkih osobina poput spina.[68] Na periodnom sistemu elemenata, atomi teže povećanju atomskog radijusa idući kroz periode prema dolje, te smanjivanju idući s lijeva na desno kroz grupe hemijskih elemenata.[69] Kao posljedica toga, najmanji atom po atomskim radijusima jeste helij sa radijusom od 32 pikometra, dok je jedan od najvećih cezij sa 225 pikometara.[70]
Kada na njega djeluju vanjske sile poput električnog polja, oblika atoma može značajno odstupiti od loptaste simetrije. Deformacija zavisi od snage električnog polja i vrste orbite krajnje vanjske elektronske ljuske, kako to predviđaju teorije grupa. Asferične (neloptaste) devijacije mogu biti izazvane naprimjer u kristalima, gdje se velika kristalno-električna polja mogu javiti na mjestima rešetke s niskom simetrijom.[71][72] Značajne elipsoidne deformacije mogu se javiti kod iona sumpora[73] i halkogenih iona[74] u spojevima sličnih piritu. Veličina atoma je reda veličine oko hiljadu puta manja talasne dužine vidljive svjetlosti (400–700 nm) tako da se oni ne mogu vidjeti pod optičkim mikroskopom. Međutim, pomoću skenirajućeg tunelskog mikroskopa moguće je vidjeti pojedinačne atome. Da bi se lakše predstavila veličina atoma, smatra se da je debljina obične ljudske dlake u prečniku reda oko milion atoma ugljika.[75] Jedna kap vode sadrži približno 2 x 1021
atoma kisika i dvostruko veći broj atoma vodika.[76] Dijamant od jednog karata, mase 2×10−4 kg, sadrži oko 1022 atoma ugljika.[note 2] Kada bi se jabuka povećala do veličine planete Zemlje, tada bi atomi te jabuke bili približno veličine prvobitne jabuke.[77]
Radioaktivni raspad[uredi | uredi kod]

Svaki element ima jedan ili više izotopa koji imaju nestabilno jezgro i koje se raspada nekim od radioaktivnih načina raspada, pri čemu jezgro emitira čestice ili elektromagnetsku radijaciju. Radioaktivnost se može javiti kada je radijus atomskog jezgra dosta veći u odnosu na radijus jake sile, koja može djelovati samo na udaljenostima reda veličine 1 fm.[78]
Neki od najčešćih načina radioaktivnog raspada su:[79][80]
- Alfa raspad: ovaj proces dešava se kada jezgro emitira alfa-česticu, koja je zapravo jezgro atoma helija sa dva protona i dva neutrona. Rezultat ove emisije je novi element sa nižim atomskim brojem.
- Beta raspad (i elektronski zahvat): ove procese regulira slaba sila a njihov rezultat je transformacija jednog neutrona u proton ili obrnuto. Prijelaz iz neutrona u proton dešava se istovremeno sa emisijom elektrona i antineutrina, dok prijelaz iz protona u neutron (osim kod elektronskog zahvata) uzrokuje emisiju pozitrona i neutrina. Emisije elektrona ili pozitrona nazivaju se beta čestice. Pri beta raspadu dešava se ili povećanje ili smanjenje atomskog broja jezgra za jedan. Elektronski zahvat je mnogo češći od emisije pozitrona jer je za njega potrebno mnogo manje energije. Kod ove vrste raspada, jezgro apsorbira jedan elektron umjesto da se iz njega emitira pozitron. U tom procesu se i dalje emitira neutrino a proton prelazi u neutron.
- Gama raspad: u ovom procesu dolazi do promjene energetskih nivoa jezgra u niže stanje, što dovodi do emisije elektromagnetskog zračenja. Pobuđeno stanje jezgra rezultira gama zračenjem nakon čega dolazi do emisije alfa ili beta čestice. Prema tome, nakon gama raspada najčešće slijedi alfa ili beta raspad.
Postoje i neki rijetki tipovi radioaktivnog raspada koji, između ostalog, uključuju izbacivanje neutrona ili protona ili grupe nukleona iz jezgra, ili više od jedne beta čestice. Analogno gama zračenju koje omogućava pobuđenom jezgru da izgubi energiju na jedan od načina, postoji i proces interne konverzije kojim nastaju izuzetno brzi elektroni a koji ne spadaju u beta zrake, dok istovremeno nastaju visokoenergetski fotoni koji nisu gama zraci. Također, moguće je da nekoliko velikih atomskih jezgara eksplodira dajući dva ili više nabijenih fragmenata raznih masa te nekoliko neutrona u procesu koji se naziva spontana nuklearna fisija.
Svaki radioaktivni izotop ima karakteristično vrijeme raspada koje se naziva vrijeme poluraspada. Ono je definirano kao vremenski period potreban da se raspadne polovina uzorka tog izotopa. To je proces eksponencijalnog raspada kojim se stalno smanjuje preostali udio nekog izotopa za 50% za svaki period vremena poluraspada. Prema tome, nakon dva perioda vremena poluraspada preostaje samo 25% prvobitne količine izotopa i tako dalje.[78]
Magnetni moment[uredi | uredi kod]
Elementarne čestice imaju vlastitu kvantno-mehaničku osobinu poznatu kao spin. On je analogan ugaonom momentu nekog predmeta koji se okreće oko svog centra mase, mada ako se uzme prema definiciji, ove čestice se smatraju tačkama i pa se ne može reći da rotiraju. Spin se mjeri u jedinicama reducirane Planckove konstante (ħ), pri čemu elektroni, protoni i neutroni imaju spin ½ ħ, ili "spin-½". U atomu, elektroni koji se kreću oko jezgra, pored spina, imaju i orbitalni ugaoni moment, dok samo jezgro ima vlastiti ugaoni moment zbog svog nuklearnog spina.[81]
Atom proizvodi magnetno polje, odnosno magnetni moment, koji se određuje prema tim raznim oblicima ugaonog momenta, slično kao svaki rotirajući naelektrisani objekat koji proizvodi magnetno polje. Ipak, najznačajniji doprinos nastanku ovog polja dolazi od spina elektrona. Zbog prirode elektrona da se ponašaju prema Paulijevom principu isključenja, prema kojem se dva elektrona ne mogu nalaziti u istom kvantnom stanju, vezani elektroni se uparuju međusobno, pri čemu jedan član svakog elektronskog para ima stanje spina up dok drugi član ima suprotno stanje spina, down. Prema tome, ova dva stanja spina se međusobno poništavaju, smanjujući ukupni magnetni dipol moment na nulu kod nekih atoma koji imaju paran broj elektrona.[82]
Kod feromagnetnih elemenata poput željeza, kobalta i nikla, neparan broj elektrona dovodi do postojanja nesparenog elektrona i pojavu određenog ukupnog magnetnog momenta. Orbitale susjednih atoma se preklapaju te se dostiže stanje niže energije kada se spinovi nesparenih elektrona spontano "poravnaju" jedan s drugim, što se naziva interakcija izmjene. Kada se poravnaju magnetni momenti feromagnetnih atoma, tada predmet ili materijal može proizvesti mjerljivo makroskopsko magnetno polje. Paramagnetni materijali imaju atome sa magnetnim momentima koji se poravnavaju u nasumičnim pravcima kada nije prisutno magnetno polje, ali se u prisustvu takvog polja poravnaju (usmjere u istom pravcu).[82][83]
Jezgro atoma neće imati nikakav spin kada u sebi sadrži paran broj i neutrona i protona, međutim u slučajevima kada su neparni brojevi nukleona, onda i jezgro može imati spin. Obično su jezgra sa spinom poravnati u nasumičnim pravcima zbog termalne ravnoteže. Međutim, kod određenih elemenata (poput ksenona-129) moguće je da se polariziraju značajni udjeli stanja nuklearnog spina tako da su onda jezgra poravnata u istom pravu. Takvo stanje u fizici naziva se hiperpolarizacija. Ona ima vrlo važne oblasti primjene naprimjer pri snimanju magnetnom rezonancom.[84][85]
Energetski nivoi[uredi | uredi kod]

Potencijalna energija elektrona u atomu je negativna, a zavisnost njegove pozicije doseže minimum (najvišu apsolutnu vrijednost) unutar jezgra, te potpuno nestaje kada udaljenost od jezgra dosegne beskonačnost, ugrubo računajući obrnutno proporcionalno udaljenosti. Prema kvantno-mehaničkom modelu, vezani elektron može zauzeti samo jedan set kvantnih stanja sa centrom u jezgru, a svako stanje odgovara određenom energetskom nivou. Teoretsko razmatranje tog modela obrađuje vremenski nezavisna Schrödingerova jednačina. Energetski nivo može biti izmjeren pomoću količine energije potrebne da se elektron izdvoji iz atoma, te se najčešće izražava elektronvoltima (eV). Najniže stanje energije vezanog elektrona naziva se osnovno stanje, odnosno stacionarno stanje, dok se tranzicija elektrona na neke više nivoe označava kao pobuđeno stanje.[86] Energija elektrona povećava se pri povećanju n (osnovnog kvantnog broja) jer se povećava (prosječna) udaljenost od jezgra. Zavisnost energije od ℓ nije uzrokovana elektrostatičkim potencijalom jezgra već interakcijom između elektrona.
Elektron koji prelazi između dva različita stanja, naprimjer između osnovnog i prvog pobuđenog, on mora apsorbirati ili emitirati foton energije koja odgovara razlici između potencijalnih energija ta dva nivoa, u skladu sa Bohrovim modelom, što se vrlo precizno može izračunati Schrödingerovom jednačinom. Elektroni "skaču" između orbitala na način kako bi to činili da su čestice. Naprimjer, ako jedan foton udari u više elektrona, samo jedan elektron promijeni svoje stanje kao odgovor na udar fotona. Energija emitiranog fotona proporcionalna je njegovoj frekvenciji pa se određeni specifični energetski nivoi javljaju u vidu određenih talasnih dužina elektromagnetskog spektra.[87] Svaki hemijski element ima karakterističan spektar koji zavisi od njegovog nuklearnog naboja, podljusaka napunjenih elektronima i elektromagnetnih međudjelovanja između elektrona te drugih faktora.[88]
Kada kontinuirani elektromagnetni spektar energije prođe kroz plin ili plazmu, neke fotone apsorbiraju pojedini atomi uzrokujući da elektroni promijene svoje energetske nivoe. Tako pobuđeni elektroni koji ostanu vezani na svojim atomima spontano emitiraju primljenu energiju u vidu fotona u nasumičnom pravcu te se nakon toga vraćaju na niže energetske nivoe. Na taj način atomi se ponašaju kao filteri koji formiraju seriju tamnih apsorpcijskih vrpci u izlaznom snopu energije. Posmatrač koji posmatra atome tamo gdje nema kontinuiranog spektra u pozadini, umjesto apsorpcijskih vrpci vidi serije emisijskih linija od emitiranih fotona iz atoma. Spektroskopska mjerenja snage i širine atomskih spektralnih linija omogućava određivanje sadržaja i fizičkih osobina ispitivane supstance.[89]
Detaljnijim istraživanjem spektralnih linija otkrivena je pojava izdvajanja finih spektralnih struktura. To se dešava zbog kuplovanja spina i orbitale, što predstavlja međudjelovanje između spina i kretanja najudaljenijih vanjskih elektrona.[90] Kada se atom nalazi u vanjskom magnetnom polju, spektralne linije se rasčlanjuju u tri ili više komponenti. Takav fenomen nazvan je Zeemanov efekt. On se dešava zbog međudjelovanja magnetnog polja i magnetnog momenta atoma i njegovih elektrona. Neki atomi mogu imati više elektronskih konfiguracija sa istim nivoom energije, pa oni izgledaju kao jedinstvena spektralna linija. Interakcija magnetnog polja sa atomom neznatno pomijera ove elektronske konfiguracije do drugačijih energetskih nivoa, što dovodi do pojave višestrukih spektralnih linija.[91] Prisustvo vanjskog električnog polja može također uzrokovati slična razdvajanja i pomijeranja spektralnih linija tako što se mijenjaju energetski nivoi elektrona, a taj fenomen naziva se Starkov efekt.[92]
Ako se vezani elektron nalazi u pobuđenom stanju, foton koji djeluje na njega određenom energijom može prouzrokovati stimuliranu emisiju fotona istog energetskog nivoa. Da bi se to desilo, elektron prvo mora preći na niži energetski nivo koji ima razliku u energijama koja odgovara energiji fotona koji djeluje na elektron. Emitirani foton i foton koji je međudjelovao sa elektronom odlaze u paralelnim pravcima i u istim su faznim stanjima. Drugim riječima, talasni obrazac dva fotona je sinhroniziran. Ova fizička osobina iskorištena je u raznim vrstama lasera, koji emitiraju koherentni snop svjetlosne energije u uskom frekvencijskom opsegu.[93]
Valencija i vezivanje[uredi | uredi kod]

Valencija je potencijalna snaga spajanja nekog elementa. Ona je jednaka broju atoma vodika s kojima se neki atom može spojiti ili istisnuti gradeći neki hemijski spoj. Krajnja vanjska elektronska ljuska nekog atoma u svom slobodnom, nespojenom stanju se naziva valentna ljuska, dok se elektroni u toj ljusci nazivaju valentni elektroni. Broj valentnih elektrona određuje i hemijsko vezivanje atoma s drugim atomima. Oni teže da reagiraju jedni sa drugim na način da popune (ili isprazne) svoje vanjske valentne ljuske.[94] Naprimjer, prijelaz jednog elektrona između atoma korisna je aproksimacija za veze koje nastaju između atoma sa jednim elektronom viška od potpuno popunjene orbitale, dok drugom nedostaje jedan elektron za popunu orbitale, što je proces koji se dešava u spoju natrij-hlorid i drugim ionskim solima. Međutim, kod mnogih elemenata javljaju se dva ili više valentnih stanja odnosno tendencija da dijele različit broj elektrona u različitim spojevima. Prema tome, hemijsko vezivanje između tih elemenata javlja se u raznim oblicima dijeljenja elektrona što je sasvim drugačiji oblik vezanja od jednostavnog prijelaza elektrona. Takvi primjeri su kod ugljika i organskih spojeva.[95]
U periodnom sistemu, hemijski elementi često se prikazuju tako da su grupisani prema ponavljajućim hemijskim osobinama, pa tako elementi sa istim valentnim brojem elektrona grade grupe elemenata koji su svrstani u istu kolonu tabele PSE. Horizontalne kolone odgovaraju redoslijedu popunjavanja kvantnih ljusaka elektronima. Elementi koji su svrstani u krajnju desnu kolonu tabele imaju svoju krajnju vanjsku ljusku u potpunosti popunjenu elektronima, što za posljedicu ima da su oni hemijski inertni elementi, poznati i kao plemeniti plinovi.[96][97]
Stanja[uredi | uredi kod]
Količine atoma koje se mogu naći u različitim agregatnim stanjima materije zavise od fizičkih uslova kao što su temperatura i pritisak. Mijenjanjem ovih uslova, materijali mogu prelaziti između raznih agregatnih stanja: čvrstog, tečnog, plinovitog i plazme.[98] U određenom agregatnom stanju, neka supstanca može također postojati u različitim alotropnim oblicima. Primjer alotropa je čvrsti ugljik, koji se u prirodi javlja kao grafit ili dijamant.[99] Također postoje i plinoviti alotropi kao što je to slučaj kod molekulskog kisika i ozona. Na temperaturama bliskim apsolutnoj nuli, atomi mogu formirati i Bose-Einsteinov kondenzat, u kojem efekti kvantne mehanike mogu biti posmatrani i na makroskopskoj skali.[100][101] Ova super ohlađena kolekcija atoma ponaša se kao jedan ogromni atom, na kojem se mogu vršiti fundamentalni eksperimenti o kvantno-mehaničkom ponašanju atoma.[102]
Identifikacija[uredi | uredi kod]

Skenirajući tunelski mikroskop je uređaj pomoću kojeg je moguće posmatrati površinu uzroka na atomskom nivou. On iskorištava fenomen kvantnog tuneliranja, koji omogućava da čestice prođu kroz barijeru, kroz koju inače ne bi mogle proći. Elektroni ulaze u "tunel" kroz vakuum između dvije planarne metalne elektrode, a na svakoj od njih je adsorbiran atom, dajući gustoću tunelske struje dovoljnu da se može izmjeriti. Skeniranje jednog atoma dok se kreće pored drugih omogućava iscrtavanje vrha odmaka u odnosu uporednu separaciju uz neku konstantnu struju. Izračuni pokazuju u kojoj mjeri se na slikama načinjenim skenirajućim tunelskim mikroskopom mogu vidjeti pojedinačni atomi. S tim se uz vrlo mali postotak greške potvrđuje da mikroskopske slike prikazuju prostorno prosječne dimenzije elektronskih orbitala duž gusto zbijenih energetskih nivoa, tj. Fermijev nivo lokalnih gustoća stanja.[103][104]
Atom se može ionizirati uklanjanjem jednog ili više elektrona iz njega. Električni naboj uzrokuje da se putanja atoma iskrivljuje kada on putuje kroz magnetno polje. Radijus u kojem se putanja iona koji se kreće iskrivljuje u magnetnom polju zavisi od mase atoma. Maseni spektrometar radi na ovom principu čime se mjeri odnos mase i naboja iona. Ako uzorak sadrži više izotopa, masenim spektrometrom se može odrediti proporcija svakog izotopa u uzorku, mjerenjem intenziteta različitih snopova iona. Tehnike isparavanja atoma uključuju, između ostalih, induktivno spregnutu plazmu atomsku emisionu spektroskopiju i induktivno spregnutu plazmu masenu spektroskopiju. Obje tehnike koriste plazmu da bi uzroke pretvorili u plin za analizu.[105]
Metoda kojom se može preciznije odabrati određeno područje je spektroskopija gubitka energije elektrona, kojom se mjeri gubitak energije snopa elektrona unutar transmisijskog elektronskog mikroskopa kada oni međudjeluju sa dijelom ispitivanog uzorka. Tomografija atomskom sondom ima rezoluciju manju od nanometra u trodimenzionalnom okruženju te se pomoću nje pojedini atomi mogu hemijski identificirati masenom spektrometrijom koristeći se TOF analizatorom.[106]
Spektar pobuđenih stanja se može koristiti za analizu atomskog sastava udaljenih zvijezda. Određene talasne dužine svjetlosti sadržane u posmatranoj svjetlosti koja dolazi sa neke zvijezde mogu se razdvojiti i po njima odrediti kvanizirani prijelazi u slobodnim atomima plina. Te boje se mogu replicirati koristeći sijalicu sa metalnim parama koja sadrži ispitivani element.[107] Na ovaj način otkriven je plin helij u spektru Sunčeve svjetlosti, 23 godine prije nego što je isti plin otkriven na Zemlji.[108]
Porijeklo i sadašnje stanje[uredi | uredi kod]
Barionska materija sačinjava oko 4% sveukupne gustoće energije u vidljivom svemiru, pri čemu prosječna gustoća iznosi oko 0,25 čestica/m3 (uglavnom u obliku protona i elektrona).[109] Unutar galaksija, kao što je naš Mliječni put, čestice se ponegdje nalaze u mnogo većim koncentracijama, gdje se gustoća materije u međuzvjezdanom prostoru kreće od 105 do 109 atoms/m3.[110] Smatra se da se Sunce nalazi unutar Lokalne grupe zvijezda, tako da je gustoća materije u Sunčevom komšiluku približno 103 atoma/m3.[111] Zvijezde se formiraju od gustih oblaka u međuzvjezdanom prostoru, a evolucijski procesi zvijezda rezultirali su konstantnim obogaćivanjem međuzvjezdanog prostora elementima težim od vodika i helija.
Oko 95% barionske materije Mliječnog puta koncentrirana je unutar zvijezda gdje vladaju uslovi koji ne pogoduju atomskoj materiji. Ukupna barionska masa zauzima oko 10% mase galaksije;[112] dok ostatak otpada na pretpostavljenu tamnu materiju.[113] Ekstremno visoke temperature koje vladaju unutar zvijezda mijenjaju atome tako da postaju u potpunosti ionizirani, to jest svi elektroni se odvajaju od jezgra. U kompaktnim zvijezdama, uz izuzetak njihovih površinskih slojeva, izuzetan pritisak čini nemogućim postojanje elektronskih orbitala.
Nastanak[uredi | uredi kod]
Smatra da su elektroni u Svemiru postojali još od prvih trenutaka nakon Velikog praska. Atomska jezgra formirala su se tokom nukleosintetskih reakcija. Tokom tri minute nukleosinteze nakon Velikog praska nastala je većina atoma helija, litija i deuterija u Svemiru, a možda i nešto atoma berilija i bora.[114][115][116]
Sveprisutnost i stabilnost atoma počiva na njihovoj energiji vezivanja, što znači da atom ima nižu energiju nego sistem nepovezanih atomskih jezgara i elektrona. Na mjestima gdje je temperatura znatno viša od ionizacijskog potencijala, materija postoji u obliku plazme, plina sastavljenog iz pozitivno nabijenih iona (moguće i ogoljenih jezgara) i elektrona. Kada temperatura spadne ispod ionizacijskog potencijala, atomi postaju statistički povoljni. Atomi (cijeli sa vezanim elektronima) postali su dominantni u odnosu na nabijene čestice tek 380 hiljada godina nakon Velikog praska. Ta epoha nazvana je rekombinacija, kada se Svemir pri širenju ohladio u dovoljnoj mjeri da su se elektroni počeli vezivati za atomska jezgra.[117]
Počev od Velikog praska, tokom kojeg nisu nastali atomi ugljika niti elementi teži od njega, jezgra atoma su se spajala unutar zvijezda procesom nuklearne fuzije čime su nastajale nove količine elementa helija, te (trostrukim alfa procesom) atomi elemenata počev od ugljika do željeza.[118] Taj proces naziva se zvjezdana nukleosinteza. Izotopi kao što je litij-6, kao i određena količina berilija i bora, nastali su svemiru putem procesa spalacije kosmičkim zrakama.[119] Ona se javlja kada visokoenergetski protoni udare u atomska jezgra izbijajući veći broj nukleona iz njega.
Elementi teži od željeza nastali su r-procesom tokom supernove kao i s-procesom u zvijezdama asimptotskog divovskog ogranka. Oba ova procesa uključuju zahvatanje neutrona unutar atomskog jezgra.[120] Elementi kao što je olovo uglavnom nastaju radioaktivnim raspadom težih elemenata.[121]
Zemlja[uredi | uredi kod]
Većina atoma, koji sačinjavaju planetu Zemlju i njene stanovnike, bila je prisutna u današnjem obliku u maglini koja se urušila iz molekularnog oblaka i iz koje je nastao današnji Sunčev sistem. Mali dio atoma na Zemlji rezultat je procesa radioaktivnog raspada te se relativni odnos tih atoma može koristiti za određivanje starosti Zemlje putem radiometrijskog datiranja.[122][123] Većina helija u Zemljinoj kori (oko 99% helija iz plinovitih izvora, što pokazuje i mala rasprostranjenost izotopa helija-3) proizvod je alfa raspada.[124] Postoji vrlo malo atoma u tragovima na Zemlji koji nisu bili prisutni u vrijeme njenog nastanka (tj. nisu primordijalni atomi), a nisu ni rezultat radioaktivnog raspada. Izotop ugljika-14 stalno nastaje u atmosferi djelovanjem kosmičkih zraka.[125] Neki atomi na Zemlji napravljeni su vještački bilo kao rezultat rada naučnika ili kao nusproizvod u nuklearnim reaktorima ili pri nuklearnim eksplozijama.[126][127] Od svih tranuranijskih elemenata, odnosno elemenata sa atomskim brojevima većim od 92, samo se plutonij i neptunij mogu pronaći na Zemlji u prirodnom stanju.[128][129] Transuranijski elementi imaju radioaktivni "životni vijek" znatno kraći od starosti Zemlje[130] pa su se njihove mjerljive količine već odavno raspale na lakše elemente. Jedan od rijetkih izuzetaka je izotop plutonija-244, čije tragove je moguće detektirati u sićušnim uzorcima kosmičke prašine.[123] Prirodni depoziti plutonija i neptunija nastaju zahvatom neutrona u rudama uranija.[131]
Prema određenim procjenama, na Zemlji se nalazi 1,33×1050 atoma.[132] Iako postoji vrlo mali broj atoma koji nisu vezani u molekulu, kao što su atomi plemenitih plinova: argon, neon i helij, 99% atoma u Zemljinoj atmosferi vezano je u obliku molekula poput ugljik-dioksida ili dvoatomskih molekula kisika i dušika. Na površini Zemlje, ogromna većina atoma spojena je u obliku raznih spojeva, uključujući vodu, soli, silikate i okside. Atomi su također spojeni u obliku materijala koji se ne sastoje iz molekula, kao što su kristali ili tečni i čvrsti metali.[133][134] Takva atomska materija gradi umrežene sisteme koji ne posjeduju određenu vrstu konačnog, razdijeljenog rasporeda u vrlo malom obimu, što je karakteristika molekularne materije.[135]
Rijetki i teoretski oblici[uredi | uredi kod]
Superteški elementi[uredi | uredi kod]
Iako je poznato da su izotopi sa atomskim brojem višim od 82 (olovo) radioaktivni, neki naučnici špekulišu o postojanju "ostrva stabilnosti" za neke elemente sa atomskim brojevima iznad 103. Takvi superteški elementi bi mogli imati atomska jezgra koja su relativno stabilna u odnosu na radioaktivni raspad.[136] Jedan od mogućih kandidata za stabilni superteški atom jeste unbiheksij, koji bi trebao imati 126 protona i 184 neutrona.[137]
Egzotična materija[uredi | uredi kod]
Svaka čestica materija ima odgovarajuću česticu antimaterije sa suprotnim električnim nabojem. Prema tome, pozitron je pozitivni naelektrisani antielektron dok je antiproton negativno nabijeni ekvivalent protonu. Prema pretpostavkama, kada se čestice obične materije i antimaterije dodirnu, one poništavaju jedna drugu. Iz tog razloga, zajedno sa neravnotežom između broja čestice materije i antimaterije, antimaterija je vrlo rijetka u svemiru. Konkretni razlozi za ovu neravnotežu još uvijek nisu u potpunosti shvaćeni, mada teorije bariogeneze nude određena objašnjenja. Kao rezultat te pojave, u prirodi još nisu otkriveni atomi antimaterije.[138][139] Međutim, u laboratoriji CERN u Ženevi 1996. godine sintetiziran je antimaterijski ekvivalent atomu vodika (antivodik, antihidrogen).[140][141]
Druge egzotične vrste atoma napravljene su zamjenom jednog od protona, neutrona ili elektrona sa drugim česticama iste vrste naelektrisanja. Naprimjer, elektron se može zamijeniti mnogo masivnijom česticom, mionom, pri čemu nastaje mionski atom. Takve vrste atoma se mogu koristiti za istraživanje osnovnih pretpostavki fizike.[142][143][144]
Napomena[uredi | uredi kod]
- ↑ Za najnovija ažuriranja pogledajte interaktivnu kartu nuklida (Nacionalna laboratorija Brookhaven) Arhivirano 2020-07-25 na Wayback Machine-u.
- ↑ Karat ima 200 miligrama. Po definiciji, izotop ugljik-12 ima masu 0,012 kg po molu. Avogadrova konstanta definira da u jednom molu ima 6×1023 atoma.
Izvori[uredi | uredi kod]
- Manuel, Oliver (2001). Origin of Elements in the Solar System: Implications of Post-1957 Observations. Springer. ISBN 978-0-306-46562-8. OCLC 228374906.
Reference[uredi | uredi kod]
- ↑ Pullman Bernard (1998). The Atom in the History of Human Thought. Oxford, Engleska: Oxford University Press. str. 31–33. ISBN 978-0-19-515040-7.
- ↑ 2,0 2,1 Kenny Anthony (2004). Ancient Philosophy. A New History of Western Philosophy. 1. Oxford, Engleska: Oxford University Press. str. 26–28. ISBN 978-0-19-875273-8.
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 Pyle Andrew (2010). „Atoms and Atomism”. u: Grafton Anthony; Most Glenn W.; Settis Salvatore. The Classical Tradition. Cambridge, Massachusetts and London: The Belknap Press of Harvard University Press. str. 103–104. ISBN 978-0-674-03572-0.
- ↑ 4,0 4,1 4,2 4,3 Cohen Henri; Lefebvre Claire, ur. (2017). Handbook of Categorization in Cognitive Science (2 izd.). Amsterdam, Holandija: Elsevier. str. 427. ISBN 978-0-08-101107-2.
- ↑ Andrew G. van Melsen (1952). From Atomos to Atom. Mineola, NY: Dover Publications. ISBN 978-0-486-49584-2.
- ↑ Dalton, John. "On the Absorption of Gases by Water and Other Liquids", u Memoirs of the Literary and Philosophical Society of Manchester. 1803. Pristupljeno 29. augusta 2007.
- ↑ Einstein Albert (1905). „Über die von der molekularkinetischen Theorie der Wärme geforderte Bewegung von in ruhenden Flüssigkeiten suspendierten Teilchen” (de). Annalen der Physik 322 (8): 549–560. Bibcode 1905AnP...322..549E. DOI:10.1002/andp.19053220806. Arhivirano iz originala na datum 2007-07-18. Pristupljeno 2020-08-22.
- ↑ Mazo Robert M. (2002). Brownian Motion: Fluctuations, Dynamics, and Applications. Oxford University Press. str. 1–7. ISBN 978-0-19-851567-8. OCLC 48753074.
- ↑ Lee Y.K.; Hoon, K. (1995). „Brownian Motion”. Imperial College. Arhivirano iz originala na datum 18. 12. 2007. Pristupljeno 20. 5. 2019.
- ↑ Patterson G. (2007). „Jean Perrin and the triumph of the atomic doctrine”. Endeavour 31 (2): 50–53. DOI:10.1016/j.endeavour.2007.05.003. PMID 17602746.
- ↑ Thomson J.J.. „On bodies smaller than atoms”. The Popular Science Monthly: 323–335.
- ↑ „J.J. Thomson”. Nobelova fondacija. 1906. Pristupljeno 20. 12. 2007.
- ↑ Rutherford E. (1911). „The Scattering of α and β Particles by Matter and the Structure of the Atom”. Philosophical Magazine 21 (125): 669–688. DOI:10.1080/14786440508637080.
- ↑ „Frederick Soddy, The Nobel Prize in Chemistry 1921”. Nobelova fondacija. Pristupljeno 18. 1. 2008.
- ↑ Thomson Joseph John (1913). „Rays of positive electricity”. Proceedings of the Royal Society. A 89 (607): 1–20. Bibcode 1913RSPSA..89....1T. DOI:10.1098/rspa.1913.0057.
- ↑ Stern David P.. „The Atomic Nucleus and Bohr's Early Model of the Atom”. NASA/Svemirski centar Goddard. Arhivirano iz originala na datum 2007-08-20. Pristupljeno 2020-08-22.
- ↑ Bohr Niels. „Niels Bohr, The Nobel Prize in Physics 1922, Nobel Lecture”. Nobelova fondacija. Pristupljeno 16. 2. 2008.
- ↑ 18,0 18,1 18,2 Pais Abraham (1986). Inward Bound: Of Matter and Forces in the Physical World. New York: Oxford University Press. str. 228–230. ISBN 978-0-19-851971-3.
- ↑ Lewis Gilbert N. (1916). „The Atom and the Molecule”. Journal of the American Chemical Society 38 (4): 762–786. DOI:10.1021/ja02261a002.
- ↑ Scerri Eric R. (2007). The periodic table: its story and its significance. Oxford University Press US. str. 205–226. ISBN 978-0-19-530573-9.
- ↑ Langmuir Irving (1919). „The Arrangement of Electrons in Atoms and Molecules”. Journal of the American Chemical Society 41 (6): 868–934. DOI:10.1021/ja02227a002.
- ↑ Scully Marlan O.; Lamb, Willis E.; Barut, Asim (1987). „On the theory of the Stern-Gerlach apparatus”. Foundations of Physics 17 (6): 575–583. Bibcode 1987FoPh...17..575S. DOI:10.1007/BF01882788.
- ↑ Chad Orzel. „What is the Heisenberg Uncertainty Principle?”. TED-Ed.
- ↑ Brown Kevin (2007). „The Hydrogen Atom”. MathPages. Pristupljeno 21. 12. 2007.
- ↑ Harrison David M. (2000). „The Development of Quantum Mechanics”. Univerzitet u Torontu. Arhivirano iz originala na datum 25. 12. 2007. Pristupljeno 21. 12. 2007.
- ↑ Aston Francis W. (1920). „The constitution of atmospheric neon”. Philosophical Magazine 39 (6): 449–455. DOI:10.1080/14786440408636058.
- ↑ Chadwick James. „Nobel Lecture: The Neutron and Its Properties”. Nobelova fondacija. Pristupljeno 21. 12. 2007.
- ↑ Bowden Mary Ellen (1997). „Otto Hahn, Lise Meitner, and Fritz Strassmann”. Chemical achievers : the human face of the chemical sciences. Philadelphia, PA: Chemical Heritage Foundation. str. 76–80, 125. ISBN 978-0-941901-12-3.
- ↑ „Otto Hahn, Lise Meitner, and Fritz Strassmann”. Science History Institute. Pristupljeno 20. 3. 2018.
- ↑ Meitner Lise; Frisch Otto Robert (1939). „Disintegration of uranium by neutrons: a new type of nuclear reaction”. Nature 143 (3615): 239–240. Bibcode 1939Natur.143..239M. DOI:10.1038/143239a0.
- ↑ Schroeder M.. „Lise Meitner – Zur 125. Wiederkehr Ihres Geburtstages” (de). Arhivirano iz originala na datum 19. 7. 2011. Pristupljeno 4. 6. 2009.
- ↑ Crawford E.; Sime Ruth Lewin; Walker Mark (1997). „A Nobel tale of postwar injustice”. Physics Today 50 (9): 26–32. Bibcode 1997PhT....50i..26C. DOI:10.1063/1.881933.
- ↑ Kullander Sven. „Accelerators and Nobel Laureates”. Nobelova fondacija. Pristupljeno 31. 1. 2008.
- ↑ „The Nobel Prize in Physics 1990”. Nobelova fondacija. Pristupljeno 31. 1. 2008.
- ↑ Demtröder Wolfgang (2002). Atoms, Molecules and Photons: An Introduction to Atomic- Molecular- and Quantum Physics (1 izd.). Springer. str. 39–42. ISBN 978-3-540-20631-6. OCLC 181435713.
- ↑ Woan Graham (2000). The Cambridge Handbook of Physics. Cambridge University Press. str. 8. ISBN 978-0-521-57507-2. OCLC 224032426.
- ↑ Mohr, P.J.; Taylor, B.N.; Newell, D.B. (2014), "The 2014 CODATA Recommended Values of the Fundamental Physical Constants" (Web verzija 7.0). Bazu podataka razvili su J. Baker, M. Douma i S. Kotochigova. (2014). Nacionalni institut za standarde i tehnologiju SAD, Gaithersburg, Maryland 20899.
- ↑ MacGregor Malcolm H. (1992). The Enigmatic Electron. Oxford University Press. str. 33–37. ISBN 978-0-19-521833-6. OCLC 223372888.
- ↑ 39,0 39,1 Particle Data Group (2002). „The Particle Adventure”. Lawrence Berkeley Laboratory. Arhivirano iz originala na datum 4. 1. 2007. Pristupljeno 3. 1. 2007.
- ↑ 40,0 40,1 James Schombert. „Elementary Particles”. University of Oregon. Arhivirano iz originala na datum 2011-08-30. Pristupljeno 2015-04-25.
- ↑ Jevremovic Tatjana (2005) (en). Nuclear Principles in Engineering. Springer. str. 63. ISBN 978-0-387-23284-3. OCLC 228384008.
- ↑ Pfeffer Jeremy I.; Nir Shlomo (2000). Modern Physics: An Introductory Text. Imperial College Press. str. 330–336. ISBN 978-1-86094-250-1. OCLC 45900880.
- ↑ Wenner Jennifer M.. „How Does Radioactive Decay Work?”. Carleton College. Pristupljeno 9. 1. 2008.
- ↑ 44,0 44,1 44,2 Raymond David. „Nuclear Binding Energies”. New Mexico Tech. Arhivirano iz originala na datum 2002-12-01. Pristupljeno 2015-04-25.
- ↑ Mihos Chris. „Overcoming the Coulomb Barrier”. Case Western Reserve University. Pristupljeno 13. 2. 2008.
- ↑ uredništvo. „ABC's of Nuclear Science”. Lawrence Berkeley National Laboratory. Arhivirano iz originala na datum 5. 12. 2006. Pristupljeno 3. 1. 2007.
- ↑ Arjun Makhijani; Saleska, Scott. „Basics of Nuclear Physics and Fission”. Institute for Energy and Environmental Research. Arhivirano iz originala na datum 16. 1. 2007. Pristupljeno 3. 1. 2007.
- ↑ Shultis J. Kenneth; Faw Richard E. (2002). Fundamentals of Nuclear Science and Engineering. CRC Press. str. 10–17. ISBN 978-0-8247-0834-4. OCLC 123346507.
- ↑ Fewell M.P. (1995). „The atomic nuclide with the highest mean binding energy”. American Journal of Physics 63 (7): 653–658. Bibcode 1995AmJPh..63..653F. DOI:10.1119/1.17828.
- ↑ Mulliken Robert S. (1967). „Spectroscopy, Molecular Orbitals, and Chemical Bonding”. Science 157 (3784): 13–24. Bibcode 1967Sci...157...13M. DOI:10.1126/science.157.3784.13. PMID 5338306.
- ↑ 51,0 51,1 Brucat Philip J. (2008). „The Quantum Atom”. Univerzitet Floride. Arhivirano iz originala na datum 7. 12. 2006. Pristupljeno 4. 1. 2007.
- ↑ Manthey David (2001). „Atomic Orbitals”. Orbital Central. Arhivirano iz originala na datum 10. 1. 2008. Pristupljeno 21. 1. 2008.
- ↑ Herter Terry (2006). „Lecture 8: The Hydrogen Atom”. Univerzitet Cornell. Arhivirano iz originala na datum 22. 2. 2012. Pristupljeno 14. 2. 2008.
- ↑ Bell R.E.; Elliott L.G. (1950). „Gamma-Rays from the Reaction H1(n,γ)D2 and the Binding Energy of the Deuteron”. Physical Review 79 (2): 282–285. Bibcode 1950PhRv...79..282B. DOI:10.1103/PhysRev.79.282.
- ↑ Smirnov Boris M. (2003). Physics of Atoms and Ions. Springer. str. 249–272. ISBN 978-0-387-95550-6.
- ↑ Matis Howard S.. „The Isotopes of Hydrogen”. Nacionalna laboratorija Lawrence Berkeley. Arhivirano iz originala na datum 18. 12. 2007. Pristupljeno 21. 12. 2007.
- ↑ Weiss Rick. „Scientists Announce Creation of Atomic Element, the Heaviest Yet”. Washington Post.
- ↑ 58,0 58,1 Sills Alan D. (2003). Earth Science the Easy Way. Barron's Educational Series. str. 131–134. ISBN 978-0-7641-2146-3. OCLC 51543743.
- ↑ Dumé Belle. „Bismuth breaks half-life record for alpha decay”. Physics World. Arhivirano iz originala na datum 14. 12. 2007.
- ↑ Lindsay Don. „Radioactives Missing From The Earth”. Don Lindsay Archive. Arhivirano iz originala na datum 28. 4. 2007. Pristupljeno 23. 5. 2007.
- ↑ Jagdish K. Tuli. „Nuclear Wallet Cards”. Nacionalni centar za nuklearne podatke, Nacionalna laboratorija Brookhaven. Pristupljeno 16. 4. 2011.
- ↑ 62,0 62,1 David R. Lide (ur.): CRC Handbook, 83. izd, CRC Press, 2002. ISBN 978-0849304835
- ↑ 63,0 63,1 Mills Ian; Cvitaš, Tomislav; Homann, Klaus; Kallay, Nikola; Kuchitsu, Kozo (1993). Quantities, Units and Symbols in Physical Chemistry (2 izd.). Oxford: IUPAC. str. 70. ISBN 978-0-632-03583-0. OCLC 27011505.
- ↑ Chieh Chung. „Nuclide Stability”. University of Waterloo. Arhivirano iz originala na datum 2007-08-30. Pristupljeno 2020-08-22.
- ↑ „Atomic Weights and Isotopic Compositions for All Elements”. NIST. Arhivirano iz originala na datum 31. 12. 2006. Pristupljeno 4. 1. 2007.
- ↑ „The Ame2003 atomic mass evaluation (II)”. Nuclear Physics A 729 (1): 337–676. 2003. Bibcode 2003NuPhA.729..337A. DOI:10.1016/j.nuclphysa.2003.11.003. Arhivirano iz originala na datum 2005-10-16. Pristupljeno 2020-08-22.
- ↑ Ghosh, D.C.; Biswas, R. (2002). „Theoretical calculation of Absolute Radii of Atoms and Ions. Part 1. The Atomic Radii”. Int. J. Mol. Sci. 3 (11): 87–113. DOI:10.3390/i3020087.
- ↑ „Revised effective ionic radii and systematic studies of interatomic distances in halides and chalcogenides”. Acta Crystallographica A 32 (5): 751–767. 1976. Bibcode 1976AcCrA..32..751S. DOI:10.1107/S0567739476001551.
- ↑ „Diameter of an Atom”. The Physics Factbook. 1998. Arhivirano iz originala na datum 4. 11. 2007. Pristupljeno 19. 11. 2007.
- ↑ Zumdahl Steven S. (2002). Introductory Chemistry: A Foundation (5 izd.). Houghton Mifflin. ISBN 978-0-618-34342-3. OCLC 173081482. Arhivirano iz originala na datum 4. 3. 2008. Pristupljeno 5. 2. 2008.
- ↑ Bethe, Hans (1929). „Termaufspaltung in Kristallen”. Annalen der Physik 3 (2): 133–208. Bibcode 1929AnP...395..133B. DOI:10.1002/andp.19293950202.
- ↑ Birkholz, Mario (1995). „Crystal-field induced dipoles in heteropolar crystals – I. concept”. Z. Phys. B 96 (3): 325–332. Bibcode 1995ZPhyB..96..325B. DOI:10.1007/BF01313054.
- ↑ Birkholz, M.; Rudert, R. (2008). „Interatomic distances in pyrite-structure disulfides – a case for ellipsoidal modeling of sulfur ions”. Physica Status Solidi B 245 (9): 1858–1864. Bibcode 2008PSSBR.245.1858B. DOI:10.1002/pssb.200879532.
- ↑ Birkholz, M. (2014). „Modeling the Shape of Ions in Pyrite-Type Crystals”. Crystals 4 (3): 390–403. DOI:10.3390/cryst4030390.
- ↑ urednici (2007). „Small Miracles: Harnessing nanotechnology”. Oregon State University. Pristupljeno 7. 1. 2007.
- ↑ Padilla Michael J.; Miaoulis, Ioannis; Cyr, Martha (2002). Prentice Hall Science Explorer: Chemical Building Blocks. Upper Saddle River, New Jersey: Prentice-Hall, Inc.. str. 32. ISBN 978-0-13-054091-1. OCLC 47925884.
- ↑ Feynman Richard (1995). Six Easy Pieces. The Penguin Group. str. 5. ISBN 978-0-14-027666-4. OCLC 40499574.
- ↑ 78,0 78,1 „Radioactivity”. Splung.com. Arhivirano iz originala na datum 4. 12. 2007. Pristupljeno 19. 12. 2007.
- ↑ L'Annunziata Michael F. (2003). Handbook of Radioactivity Analysis. Academic Press. str. 3–56. ISBN 978-0-12-436603-9. OCLC 16212955.
- ↑ Firestone Richard B.. „Radioactive Decay Modes”. Berkeley Laboratory. Arhivirano iz originala na datum 29. 9. 2006. Pristupljeno 7. 1. 2007.
- ↑ Hornak J.P. (2006). „Chapter 3: Spin Physics”. Rochester Institute of Technology. Arhivirano iz originala na datum 3. 2. 2007. Pristupljeno 7. 1. 2007.
- ↑ 82,0 82,1 Schroeder Paul A.. „Magnetic Properties”. Univerzitet Georgije. Arhivirano iz originala na datum 29. 4. 2007. Pristupljeno 7. 1. 2007.
- ↑ Goebel Greg. „[4.3] Magnetic Properties of the Atom”. In The Public Domain website. Arhivirano iz originala na datum 21. 8. 2011. Pristupljeno 7. 1. 2007.
- ↑ Yarris Lynn. „Talking Pictures”. Berkeley Lab Research Review. Arhivirano iz originala na datum 13. 1. 2008.
- ↑ Liang Z.-P.; Haacke E.M. (1999). Webster, J.G.. ur. Encyclopedia of Electrical and Electronics Engineering: Magnetic Resonance Imaging. 2. John Wiley & Sons. str. 412–426. ISBN 978-0-471-13946-1.
- ↑ Zeghbroeck Bart J. Van (1998). „Energy levels”. Shippensburg University. Arhivirano iz originala na datum 15. 1. 2005. Pristupljeno 23. 12. 2007.
- ↑ Fowles Grant R. (1989). Introduction to Modern Optics. Courier Dover Publications. str. 227–233. ISBN 978-0-486-65957-2. OCLC 18834711.
- ↑ Martin W.C.; Wiese, W.L.. „Atomic Spectroscopy: A Compendium of Basic Ideas, Notation, Data, and Formulas”. National Institute of Standards and Technology. Arhivirano iz originala na datum 8. 2. 2007. Pristupljeno 8. 1. 2007.
- ↑ „Atomic Emission Spectra – Origin of Spectral Lines”. Avogadro Web Site. Arhivirano iz originala na datum 28. 2. 2006. Pristupljeno 10. 8. 2006.
- ↑ Fitzpatrick Richard. „Fine structure”. University of Texas at Austin. Pristupljeno 14. 2. 2008.
- ↑ Weiss Michael (2001). „The Zeeman Effect”. University of California-Riverside. Arhivirano iz originala na datum 2. 2. 2008. Pristupljeno 6. 2. 2008.
- ↑ Beyer H.F.; Shevelko V.P. (2003). Introduction to the Physics of Highly Charged Ions. CRC Press. str. 232–236. ISBN 978-0-7503-0481-8. OCLC 47150433.
- ↑ Watkins Thayer. „Coherence in Stimulated Emission”. San José State University. Arhivirano iz originala na datum 12. 1. 2008. Pristupljeno 23. 12. 2007.
- ↑ Reusch William. „Virtual Textbook of Organic Chemistry”. Michigan State University. Arhivirano iz originala na datum 29. 10. 2007. Pristupljeno 11. 1. 2008.
- ↑ „Covalent bonding – Single bonds”. chemguide. 2000.
- ↑ Husted Robert. „Periodic Table of the Elements”. Nacionalna laboratorija Los Alamos. Arhivirano iz originala na datum 10. 1. 2008. Pristupljeno 11. 1. 2008.
- ↑ Rudy Baum (2003). „It's Elemental: The Periodic Table”. Chemical & Engineering News.
- ↑ Goodstein David L. (2002). States of Matter. Courier Dover Publications. str. 436–438. ISBN 978-0-13-843557-8.
- ↑ Brazhkin Vadim V. (2006). „Metastable phases, phase transformations, and phase diagrams in physics and chemistry”. Physics-Uspekhi 49 (7): 719–724. Bibcode 2006PhyU...49..719B. DOI:10.1070/PU2006v049n07ABEH006013.
- ↑ Myers Richard (2003). The Basics of Chemistry. Greenwood Press. str. 85. ISBN 978-0-313-31664-7. OCLC 50164580.
- ↑ urednici. „Bose-Einstein Condensate: A New Form of Matter”. National Institute of Standards and Technology. Arhivirano iz originala na datum 3. 1. 2008.
- ↑ Colton Imogen; Fyffe, Jeanette. „Super Atoms from Bose-Einstein Condensation”. Univerzitet Melbournea. Arhivirano iz originala na datum 29. 8. 2007. Pristupljeno 6. 2. 2008.
- ↑ Jacox Marilyn; Gadzuk, J. William. „Scanning Tunneling Microscope”. Nacionalni institut za standarde i tehnologiju SAD. Arhivirano iz originala na datum 7. 1. 2008. Pristupljeno 11. 1. 2008.
- ↑ „The Nobel Prize in Physics 1986”. Nobelova fondacija. Pristupljeno 11. 1. 2008.
- ↑ N. Jakubowski; Moens Luc; Vanhaecke Frank (1998). „Sector field mass spectrometers in ICP-MS”. Spectrochimica Acta Part B: Atomic Spectroscopy 53 (13): 1739–1763. Bibcode 1998AcSpe..53.1739J. DOI:10.1016/S0584-8547(98)00222-5.
- ↑ Müller Erwin W.; Panitz John A.; McLane S. Brooks (1968). „The Atom-Probe Field Ion Microscope”. Review of Scientific Instruments 39 (1): 83–86. Bibcode 1968RScI...39...83M. DOI:10.1063/1.1683116.
- ↑ Lochner Jim; Gibb, Meredith; Newman, Phil. „What Do Spectra Tell Us?”. NASA/Goddard svemirski centar. Arhivirano iz originala na datum 16. 1. 2008. Pristupljeno 3. 1. 2008.
- ↑ Winter Mark (2007). „Helium”. WebElements. Arhivirano iz originala na datum 30. 12. 2007. Pristupljeno 3. 1. 2008.
- ↑ Hinshaw Gary. „What is the Universe Made Of?”. NASA/WMAP. Arhivirano iz originala na datum 31. 12. 2007. Pristupljeno 7. 1. 2008.
- ↑ Choppin Gregory R.; Liljenzin Jan-Olov; Rydberg Jan (2001). Radiochemistry and Nuclear Chemistry. Elsevier. str. 441. ISBN 978-0-7506-7463-8. OCLC 162592180.
- ↑ Davidsen Arthur F. (1993). „Far-Ultraviolet Astronomy on the Astro-1 Space Shuttle Mission”. Science 259 (5093): 327–334. Bibcode 1993Sci...259..327D. DOI:10.1126/science.259.5093.327. PMID 17832344.
- ↑ Lequeux James (2005). The Interstellar Medium. Springer. str. 4. ISBN 978-3-540-21326-0. OCLC 133157789.
- ↑ Nigel Smith. „The search for dark matter”. Physics World. Arhivirano iz originala na datum 16. 2. 2008. Pristupljeno 14. 2. 2008.
- ↑ Croswell Ken (1991). „Boron, bumps and the Big Bang: Was matter spread evenly when the Universe began? Perhaps not; the clues lie in the creation of the lighter elements such as boron and beryllium”. New Scientist (1794): 42. Arhivirano iz originala na datum 7. 2. 2008.
- ↑ Copi Craig J.; Schramm DN; Turner MS (1995). „Big-Bang Nucleosynthesis and the Baryon Density of the Universe”. Science 267 (5195): 192–199. arXiv:astro-ph/9407006. Bibcode 1995Sci...267..192C. DOI:10.1126/science.7809624. PMID 7809624.
- ↑ Hinshaw Gary. „Tests of the Big Bang: The Light Elements”. NASA/WMAP. Arhivirano iz originala na datum 17. 1. 2008. Pristupljeno 13. 1. 2008.
- ↑ Abbott Brian. „Microwave (WMAP) All-Sky Survey”. Hayden Planetarium. Arhivirano iz originala na datum 13. 2. 2013. Pristupljeno 13. 1. 2008.
- ↑ F. Hoyle (1946). „The synthesis of the elements from hydrogen”. Monthly Notices of the Royal Astronomical Society 106 (5): 343–383. Bibcode 1946MNRAS.106..343H. DOI:10.1093/mnras/106.5.343.
- ↑ Knauth D.C.; Lambert David L.; Crane P. (2000). „Newly synthesized lithium in the interstellar medium”. Nature 405 (6787): 656–658. Bibcode 2000Natur.405..656K. DOI:10.1038/35015028. PMID 10864316.
- ↑ Mashnik Stepan G. (2000). „On Solar System and Cosmic Rays Nucleosynthesis and Spallation Processes”. MISSING LINK. .
- ↑ Geološki zavod Kansasa. „Age of the Earth”. Univerzitet Kansasa. Arhivirano iz originala na datum 2008-07-05. Pristupljeno 2020-08-22.
- ↑ Dalrymple G. Brent (2001). „The age of the Earth in the twentieth century: a problem (mostly) solved”. Geological Society, London, Special Publications 190 (1): 205–221. Bibcode 2001GSLSP.190..205D. DOI:10.1144/GSL.SP.2001.190.01.14.
- ↑ 123,0 123,1 Manuel 2001: str. 407–430, 511–519
- ↑ Anderson Don L.; Foulger, G.R.; Meibom, Anders. „Helium: Fundamental models”. MantlePlumes.org. Arhivirano iz originala na datum 8. 2. 2007. Pristupljeno 14. 1. 2007.
- ↑ Pennicott Katie. „Carbon clock could show the wrong time”. PhysicsWeb. Arhivirano iz originala na datum 15. 12. 2007.
- ↑ Yarris Lynn. „New Superheavy Elements 118 and 116 Discovered at Berkeley Lab”. Berkeley Lab. Arhivirano iz originala na datum 9. 1. 2008.
- ↑ Diamond, H (1960). „Heavy Isotope Abundances in Mike Thermonuclear Device”. Physical Review 119 (6): 2000–2004. Bibcode 1960PhRv..119.2000D. DOI:10.1103/PhysRev.119.2000.
- ↑ Poston Sr.; John W.. „Do transuranic elements such as plutonium ever occur naturally?”. Scientific American.
- ↑ Keller C (1973). „Natural occurrence of lanthanides, actinides, and superheavy elements”. Chemiker Zeitung 97 (10): 522–530. OSTI 4353086.
- ↑ Zaider Marco; Rossi Harald H. (2001). Radiation Science for Physicians and Public Health Workers. Springer. str. 17. ISBN 978-0-306-46403-4. OCLC 44110319.
- ↑ „Oklo Fossil Reactors”. Curtin University of Technology. Arhivirano iz originala na datum 18. 12. 2007. Pristupljeno 15. 1. 2008.
- ↑ Weisenberger Drew. „How many atoms are there in the world?”. Jefferson Lab. Pristupljeno 16. 1. 2008.
- ↑ Pidwirny Michael. „Fundamentals of Physical Geography”. University of British Columbia Okanagan. Arhivirano iz originala na datum 21. 1. 2008. Pristupljeno 16. 1. 2008.
- ↑ Anderson Don L. (2002). „The inner inner core of Earth”. Proceedings of the National Academy of Sciences 99 (22): 13966–13968. Bibcode 2002PNAS...9913966A. DOI:10.1073/pnas.232565899. PMC 137819. PMID 12391308.
- ↑ Pauling Linus (1960). The Nature of the Chemical Bond. Cornell University Press. str. 5–10. ISBN 978-0-8014-0333-0. OCLC 17518275.
- ↑ anonimni autor. „Second postcard from the island of stability”. CERN Courier. Arhivirano iz originala na datum 3. 2. 2008.
- ↑ Jacoby Mitch (2006). „As-yet-unsynthesized superheavy atom should form a stable diatomic molecule with fluorine”. Chemical & Engineering News 84 (10): 19. DOI:10.1021/cen-v084n010.p019a.
- ↑ Koppes Steve. „Fermilab Physicists Find New Matter-Antimatter Asymmetry”. Univerzitet u Chicagu.
- ↑ Cromie William J.. „A lifetime of trillionths of a second: Scientists explore antimatter”. Glasilo Univerziteta Harvard. Pristupljeno 14. 1. 2008.
- ↑ Hijmans Tom W. (2002). „Particle physics: Cold antihydrogen”. Nature 419 (6906): 439–440. Bibcode 2002Natur.419..439H. DOI:10.1038/419439a. PMID 12368837.
- ↑ urednici. „Researchers 'look inside' antimatter”. BBC News.
- ↑ Barrett Roger (1990). „The Strange World of the Exotic Atom”. New Scientist (1728): 77–115. Arhivirano iz originala na datum 21. 12. 2007.
- ↑ Indelicato Paul (2004). „Exotic Atoms”. Physica Scripta T112 (1): 20–26. arXiv:physics/0409058. Bibcode 2004PhST..112...20I. DOI:10.1238/Physica.Topical.112a00020.
- ↑ Ripin Barrett H.. „Recent Experiments on Exotic Atoms”. Američko fizičko društvo. Arhivirano iz originala na datum 23. 7. 2012. Pristupljeno 15. 2. 2008.
Vanjske veze[uredi | uredi kod]
| U Wikimedijinoj ostavi nalazi se članak na temu: Atom | |
| U Wikimedijinoj ostavi ima još materijala vezanih za: Atom | |
| Potražite izraz atom u W(j)ečniku, slobodnom rječniku. |
- Web courseware Povijest fizike Arhivirano 2012-08-02 na Wayback Machine-u
- s_HEUHyoZWI "Quantum Mechanics and the Structure of Atoms" na YouTube
- Freudenrich, Craig C.. „How Atoms Work”. How Stuff Works. Arhivirano iz originala na datum 2007-01-08. Pristupljeno 9 January 2007.
- „The Atom”. Free High School Science Texts: Physics. Wikibooks. Pristupljeno 10 July 2010.
- Anonymous (2007). „The atom”. Science aid+. Pristupljeno 10 July 2010.—a guide to the atom for teens.
- Anonymous (3 January 2006). „Atoms and Atomic Structure”. BBC. Arhivirano iz originala na datum 2007-01-02. Pristupljeno 11 January 2007.
- Various (3 January 2006). „Physics 2000, Table of Contents”. University of Colorado. Arhivirano iz originala na datum 2008-01-14. Pristupljeno 11 January 2008.
- Various (3 February 2006). „What does an atom look like?”. University of Karlsruhe. Arhivirano iz originala na datum 2010-04-17. Pristupljeno 12 May 2008.



