Berilijum
| |||||||||||||||||||||||||||||||
| Opšti podaci | |||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Ime, simbol, atomski broj | berilijum, Be, 4 | ||||||||||||||||||||||||||||||
| Pripadnost skupu | zemljani alkalni metali | ||||||||||||||||||||||||||||||
| grupa, perioda | IIA, 2, | ||||||||||||||||||||||||||||||
| gustina, tvrdoća | 1848 kg/m3, 5,5 | ||||||||||||||||||||||||||||||
| Boja | srebrnobela 
| ||||||||||||||||||||||||||||||
| Osobine atoma | |||||||||||||||||||||||||||||||
| atomska masa | 9,01218 u | ||||||||||||||||||||||||||||||
| atomski radijus | 112 pm | ||||||||||||||||||||||||||||||
| kovalentni radijus | 90 pm | ||||||||||||||||||||||||||||||
| van der Valsov radijus | bez podataka | ||||||||||||||||||||||||||||||
| elektronska konfiguracija | 1s22s2 | ||||||||||||||||||||||||||||||
| e- na energetskim nivoima | 2, 2 | ||||||||||||||||||||||||||||||
| oksidacioni broj | 2 | ||||||||||||||||||||||||||||||
| Osobine oksida | amfoterni | ||||||||||||||||||||||||||||||
| kristalna struktura | heksagonalna | ||||||||||||||||||||||||||||||
| Fizičke osobine | |||||||||||||||||||||||||||||||
| agregatno stanje | čvrsto | ||||||||||||||||||||||||||||||
| temperatura topljenja | 1551,15 K (1278 °C) | ||||||||||||||||||||||||||||||
| temperatura ključanja | 3243,15 K (2970 °C) | ||||||||||||||||||||||||||||||
| molska zapremina | 4,85×10-3 m3/mol | ||||||||||||||||||||||||||||||
| toplota isparavanja | 292,40 kJ/mol | ||||||||||||||||||||||||||||||
| toplota topljenja | 12,20 kJ/mol | ||||||||||||||||||||||||||||||
| pritisak zasićene pare | 4180 Pa | ||||||||||||||||||||||||||||||
| brzina zvuka | 13000 m/s | ||||||||||||||||||||||||||||||
| Ostale osobine | |||||||||||||||||||||||||||||||
| Elektronegativnost | 1,57 (Pauling) 1,47 (Alred) | ||||||||||||||||||||||||||||||
| specifična toplota | 1825 J/(kg*K) | ||||||||||||||||||||||||||||||
| specifična provodljivost | 31,3×106 S/m | ||||||||||||||||||||||||||||||
| >toplotna provodljivost | 201 W/(m*K) | ||||||||||||||||||||||||||||||
| I energija jonizacije | 899,5 kJ/mol | ||||||||||||||||||||||||||||||
| II energija jonizacije | 1757,1 kJ/mol | ||||||||||||||||||||||||||||||
| III energija jonizacije | 14848,7 kJ/mol | ||||||||||||||||||||||||||||||
| Najstabilniji izotopi | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Tamo gde drugačije nije naznačeno, upotrebljene su SI jedinice i normalni uslovi.
| |||||||||||||||||||||||||||||||
| Objašnjenja skraćenica: zast.=zastupljenost u prirodi, v.p.r.=vreme polu raspada, n.r.=način raspada, e.r.=energija raspada, p.r.=proizvod raspada, | |||||||||||||||||||||||||||||||
Berilij (bos., hrv.) ili Berilijum (srp.; Be, latinski - beryllium) - hemijski element, metal IIA grupe. Njegova rasprostranjenost u gornjim slojevima Zemlje iznosi 0,0002%. Jedini stabilni izotop mu je 9Be.
Berilij je dvovalentan, u prirodi se može naći samo u spoju s drugim elementima, u mineralima. Poznato drago kamenje koje sadrži berilij su beril (zeleni beril nazivamo smaragd, a plavi akvamarin) i krisoberil. Samostalni berilij je čelično sive boje, jak, lagan i krt zemnoalkalijski metal. Prvenstveno se koristi kao dodatak za otvdnjavanje legura, posebno za berilij-bakar, koji ima visoku čvrstoću, nemagnetičan je i ne iskri. Berilij ima vrlo malu gustoću (1,85 puta teži od vode), visoku točku taljenja, visoku toplinsku stabilnost i mali koeficijent topliskog širenja. Idealan je materijal za zrakoplove, koristi se za mlaznice na raketnim motorima i imati će znatan udio u strukturi budućeg svemirskog teleskopa. Ima relativno visoku prozirnost za rendgenske zrake i za ostalo radioaktivno zračenje, pa se dosta koristi kao filter ili prozor kod radioaktivnih primjena, a dosta se koristi i kod pokusa s elementarnim česticama.
Tržišna primjena berilija je veliki izazov zbog otrovnost (posebno udisanjem) prašine koja sadrži berilij. On nagriza tkiva i uzrokuje alergičnu bolest, koja može biti opasna po život, zove se berilioza[1].
Budući da se ne stvara u zvijezdama, berilij je dosta rijedak materijal, i na Zemlji i u svemiru. Za njega se ne zna je li koristan za građu biljaka i životinja.
Historija[uredi | uredi kod]
Nicolas-Luis Vauquelin 1798. godine proizveo je berilijev oksid iz minerala berila i smaragda. Friedrich Wöhler i Antoine Bussy su 1828. godine uspjeli iz berilijevog klorida izolirati čisti element uz pomoć elementarnog kalija.
Dobio je ime po grčkoj riječi βήρυλλος (biryllos) koja vuče korijene od "izblijediti", kao referenca na blijedu boju minerala berila.
Karakteristike[uredi | uredi kod]

Berilij je siv, tvrd i krt zemnoalkalijski metal, kemijski sličan aluminiju. Ima jedno od najviših tališta lakih metala, te vrlo veliku elastičnost.
Na zraku je stabilan, a zagrijavanjem se presvlači zaštitnim slojem berilijevog oksida. Praškasti berilij, zagrijan na zraku, izgara u smjesu oksida i nitrida.
Berilij u spojevima dolazi u stupnju oksidacije +2.
S vodom ne reagira niti pri 1000 °C. Otapaju ga klorovodična i sumporna kiselina, no nikako ne reagira s dušičnom. Otapa se u lužinama.
Izuzetno je krut materijal, po Youngovu modulu iskazuje 287 Gpa. Modul elastičnosti berilija je oko 50 % veći od čelika. Kombinacija tog modula i male gustoće, daje neobično visoku brzinu zvuka u beriliju (oko 12 900 m/s). Značajno svojstvo je i visoka vrijednost specifične toplinske (1925 J•kg-1•K-1) i termičke provodljivosti (216 W•m-1•K-1), što čini berilij najboljim metalom koji rasipa toplinu (hladilo) u odnosu na svoju težinu. Ima svojstvo relativno malog koeficijenta linearnog toplinskog širenja (11,4 × 10-6 K-1), što mu daje dimenzionalnu stabilnost uslijed zagrijavanja. [2]
Kod standardnog tlaka i temperature, berilij je otporan na oksidaciju, kada je izložen zraku. Ima sposobnost grebanja stakla, a to je zbog stvaranja tankog sloja tvrdog oksida BeO. Otporan je na koroziju dušične kiseline.
Nuklearna svojstva[uredi | uredi kod]
Berilij ima veliki poprečni presjek rasipanja za visoko energetske neutrone, tako da u stvari usporuje neutrone, sve do nivoa toplinske energije, kada je poprečni presjek mali (oko 0,008 barna ili 0,008 x 10-28 m2). Prevladavajući izotop berilij-9 se raspada neutronskom reakcijom na berilij-8, tako da time umnožava neutrone – više neutrona oslobađa nego upija. Ta nuklearna reakcija je:
49Be + n → 2 x 24He + 2 x n
Berilij je proziran za većinu valnih duljina rendgenskog zračenja i gama-čestica, tako da je vrlo koristan za izlazni prozor elektronskih cijevi i slične primjene. Berilij je dobar izvor kada treba mali broj slobodnih neutrona u laboratoriju. Neutroni se oslobađaju kada atomsku jezgru pogodi energetska alfa-čestica, slijedećom reakcijom:
49Be + 24He → 612C + n
gdje je 24He alfa-čestica i 612C jezgra ugljika-12. [3]
Izotopi[uredi | uredi kod]
Berilij je mononuklidni element, jer su mu svi izotopi, osim 9Be nestabilni ili se pojavljuju u tragovima.
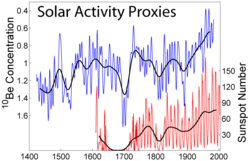
Izotop berilij-10 se stvara u Zemljinoj atmosferi sa djelovanjem kozmičkih zraka na jezgre kisika i dušika, i zato se zove kozmogenički izotop. Kozmogenični berilij-10 se nakuplja na površini tla, gdje relativno dugo vrijeme poluraspada (1,36 milijuna godina), dopušta dugi ostanak, prije rapada u bor-10. Zato se izotop berilij-10 koristi za ispitivanje prirodne erozije tla, formiranje slojeva tla, kao i za mjerenje promjena jačine Sunčevog toplinskog zračenja i za starost uzoraka jezgri leda.
Stvaranje izotopa berilija-10 je obrnuto proporcionalno s jačinom Sunčevog toplinskog zračenja, zato s pojačenjem aktivnosti Sunca (Sunčevog ciklusa), pojačava se i količina Sunčevog vjetra, a time se smanjuje količina kozmičkih zraka na površini Zemlje i nastale količine izotopa berilja-10.
Nuklearne eksplozije također povećavaju količinu izotopa berilija-10, reakcijom brzih neutrona s ugljikom-13 iz ugljičnog dioksida (CO2) u zraku, tako da je to isto pokazatelj pojačanih testova nuklearnog oružja u nekom području. [4]
Izotop berilij-7 (vrijeme poluraspada je 53 dana) je isto kozmogeničan i isto pokazuje pojačanu količinu Sunčevih pjega, slično kao berilij-10. [5]
Činjenica da berilij-8 ima jako kratko vrijeme poluraspada, ima vrlo značajne kozmološke posljedice. Elementi teži od berilija nisu se mogli stvoriti za vrijeme velikog praska, zbog nedostatka vremena, jer je nukleosinteza kod velikog praska trajala vrlo kratko, pa se nije mogao stvoriti ugljik-12 nuklearnom fuzijom helija-4 i berilija-8, koji je bio u malim koncentracijama. Britanski astronom Fred Hoyle prvi je pokazao da energetski nivoi berilija-8 i ugljika-12, pokazuju da se ugljik-12 stvarao iz trostruke nuklearne fuzije alfa-čestica, tako da se život na osnovu ugljika, mogao stvoriti iz plinova i prašine nastale izbacivanjem supernove. [6]
Izotop berilij-13 ima najkraće vrijeme poluraspada od 2,7 × 10-21 sekundi i oslobađa jedan neutron. Berilij-6 isto traje vrlo kratko s vremenom poluraspada 5,0 × 10-21 sekundi. I izotopi berilij-11 i berilij-14 traju vrlo kratko.

Rasprostranjenost[uredi | uredi kod]
Maseni udio berilija u Zemljinoj kori iznosi 0.006%. Nalazi se u stotinjak minerala, od kojih su najvažniji bertrandit (Be4Si2O7(OH)2), beril (Al2Be3Si6O18), hrizoberil (Al2BeO4), i fenakit (Be2SiO4). U obliku dragog kamenja, beril se pojavljuje kao akvamarin, biksbit i smaragd.
Dobivanje[uredi | uredi kod]
Berilij se dobiva od berila, u kojem mu je maseni udio 5%. Prvo se razlaže uz pomoć natrijevog heksafluorosilikata, čime nastaju topljivi natrijev tetrafluoroberilat i netopljivi natrijev heksafluoroaluminat. Produkt se otapa u vodi. Zatim se uparava do kristalizacije, miješa s fluoridima natrija i barija, tali na 1350 °C i elektrolizira u metal čistoće 98-98.5%.
Spojevi[uredi | uredi kod]
Sva četiri halogenida mogu se dobiti izravnom sintezom pri povišenoj temperaturi. Kovalentni su i pokazuju kiselu reakciju u vodenim otopinama.
Otapanjem hidroksida u kiselinama nastaju soli, a u lužinama berilati.
Nitrat, sulfat i perklorat iz vodenih otopina kristaliziraju kao tetrahidrati.
Upotreba[uredi | uredi kod]

Uglavnom se koristi kao dodatak drugim metalima, budući da im povećava tvrdoću i otpornost. Najčešće se rabi u slitinama bakra. Spoj berilija i bronce je vrlo čvrst, oporan i elastičan, pa se upotrebljava u izradi opruga, brodskih dijelova koji trebaju biti otporni na koroziju, u industriji satova, kompasa. Berilij odlično reflektira neutrone.
Radijacijski prozor[uredi | uredi kod]
Berilij, zbog svoje male atomske težine, je visoko proziran za rendgenske zrake, i zato se vrlo često koristi za prozore na rendgenskim elektronskim cijevima. Strogi zahtjevi se polažu na čistoću berilija, jer će svaka primjesa stvoriti smetnje na rendgenskim snimkama. Tanka berilijeva folija se koristi kao radijacijski prozor na rendgenskim detektorima, i izuzetno malo upijanje smanjuje zagrijavanje, zbog visokog intenziteta zračenja. Prozori na vakuumskim komora, kod akceleratora elementarnih čestica se isključivo radi od berilija. Kod spektroskopije s rengenskim zrakama, držač uzorka se obično radi od berilija, zbog vrlo malog upijanja rendgenskih zraka.
Berilij, zbog svoje male atomske težine je proziran i za energetske elementarne čestice. Zato se koristi za izradu zračnih cijevi, kojim putuju elementarne čestice do mjesta sudara. Berilij je jako otporan i na vrlo niske temperature, samo nekoliko stupnjeva više od apsolutne nule, a ne reagira ni s magnetskim poljima u žarištu akceleratora čestica. [7]
Mehaničke primjene[uredi | uredi kod]
Zbog svoje čvrstoće, male težine i male promjene dimenzija pod toplinskim opterećenjem, berilij kao metal se dosta koristi u vojnoj industriji, za izradu dijelova zrakoplova, projektila, svemirskih letjelica i komunikacijskih satelita. Nekoliko raketa na tekuće gorivo koriste mlaznice od čistog berilija. [8][9]
Berilij se koristi kao dodatak u proizvodnji legure berilij-bakra, koji ima do 2,5 % berilija. Koristi se u mnogim primjenama, zbog dobre kombinacije velike električne i toplinske provodljivosti, visoke čvrstoće i tvrdoće, nemagnetičnih svojstava, zbog otpornosti na koroziju i zamor materijala. Zato se koristi kod elektroda za točkasto zavarivanje, opruge, alate koji ne bacaju iskru i za električne kontakte.
Izuzetna krutost je dovela do toga da se berilij puno koristi za precizne instrumente, kao što je žiroskop, za unutrašnju vodilicu i noseću strukturu kod optičkih sistema.
Berilij se koristi i kod pištolja za pjeskarenje, koji se koriste za skidanje boje s trupova brodova. Tada se berilij dodaje bakru kao povećanje tvrdoće. [10]

Ogledala[uredi | uredi kod]
Berilij je vrlo interesantan materijal za proizvodnju ogledala. Često se koristi za noseću strukturu u obliku saća, kao recimo kod meteorolških satelita, gdje je mala težina i dugotrajna stabilnost na promjenu dimenzija, vrlo bitna. Mala berilijska ogledala se koriste u sistemima za kontrolu vatre, kao optička vodilica. Obično, berilijska ogledala su prevučena slojem nikla, koji može biti bolje poliran. Kod nekih ogledala, berilij se može polirati, pa i ne treba dodatni sloj. To se koristi kod primjena za vrlo niske (kriogenske) temperature, blizu apsolutne nule, jer zbog malog toplinskog istezanja, ne dolazi do izvijanja materijala.
Optika kod svemirskog teleskopa Spitzer je u cijelosti izrađena od berilija. Kod temperature od 33 Kelvina, ogledalo od berilija se bolje ponaša od stakla, jer se manje skuplja i deformira. [11] [12]
Prije se berilij dosta koristio kod kočnica, za vojne avione, zbog dobre tvrdoće, visoke točke topljenja i izuzetnog odvođenja topline. Zbog svoje otrovnosti, odustalo se od berilija.
Primjena zbog magnetskih svojstava[uredi | uredi kod]
Berilij je nemagnetičan. Zato se alati od berilija koriste za mornaričke i vojne timove, koji rade s eksplozivnim materijalima, kao za morske mine, koje obično imaju magnetične okidače. Isto se može naći kod materijala za održavanje i konstrukciju kod strojeva za snimanje magnetnom rezonancijom. Kod popravaka tih strojeva, ukoliko magnetični alat ostane unutra, može biti izuzetno opasno u radu tog stroja. [13]
Kod radio komunikacija i snažnih (obično vojnih) radara, ručni alat od berilija se koristi za podešavanje izuzetno jakih magnetičnih dijelova. Koristi se i kod jakih mikrovalnih odašiljača.

Nuklearna primjena[uredi | uredi kod]
Tanke pločice ili folije berilija se ponekad koriste za nuklearna oružja, za vanjski sloj okna za plutonij, da bi potakao nuklearnu fisiju. Osim što je dobar za poticanje samoeksplozije plutonija-239, dobar je reflektor neutrona kod nuklearnih reaktora.
Berilij se obično koristi u nuklearnim laboratorijima, kada je za pokus potrebna mala količina neutrona (bolje nego cijeli nuklearni reaktor). Berilij-9 se bombardira s energetskim alfa-česticama iz radioaktivnog izotopa. U nuklearnoj reakciji, jezgra berilija se pretvara u ugljik-12, a slobodni neutron izlazi iz reakcije i putuje u istom smjeru kao alfa-čestice.
Ponekad se berilij koristi kao izvor neutrona u nuklearnom oružju. On se miješa s emiterima alfa-čestica, kao što su polonij-210, radij-226, plutonij-239 ili americij-241. Koristio se i kod prvih atomskih bombi, zajedno s polonijem, kao “nestašni” poticaj neutrona. [14]
Koristi se i kod nuklearne fuzije, za strukturu koja je u kontaktu s plazmom. Njega se predlaže i za omotač kod šipki nuklearnog goriva, zbog dobrih kombinacija mehaničkih, kemijskih i nuklearnih svojstava.

Akustika[uredi | uredi kod]
Zbog svoje male težine i velike čvrstoće, koristan je i za dijelove visokofrekventnog zvučnika, ali se zbog otrovnosti sve manje primjenjuje. [15] [16] [17]
Elektronika[uredi | uredi kod]
Berilij je primjesa p-tipa kod III-V mješavine za poluvodiče. Dosta se koristi za materijale kao što su GaAs, AlGaAs, InGaAs i InAlAs. [18]
Poprečno rolane berilij trake su izvrstan nosač za tiskane pločice, a može se iskoristiti i kao hladilo. Primjena zahtijeva da koeficijent toplinskog širenja odgovara aluminijevom oksidu i poliamidima.
Berilij oksid je koristan za mnoge primjene kao električni izolator, koji ima dobru toplinsku vodljivost, visoku čvrstoću i tvrdoću, te visoku točku topljenja. Zato se koristi kao izolatorska osnovna pločica za tranzistore visoke snage, kod radio frekventnih odašiljača za telekomunikacije. [19]
Berilij se može naći i kod fluorescentnih svjetiljki, ali se odustalo, zbog toga što su radnici u proizvodnji, oboljevali od berilioze. [20]
Toksičnost[uredi | uredi kod]
Prema Međunarodnoj agenciji za istraživanje raka (engl. International Agency for Research on Cancer - IARC), berilij spade u skupinu 1 kancerogenih tvari (dokazana kancerogenost za ljude). Berilioza je plućna i alergijska bolest, uzrokovana izlaganu prašine berilija. Ta bolest je prvi puta zabilježena 1933. godine u Europi i 1943. godine u Sjedinjenim Američkim Državama. Slučajevi kroničnog berilioze su opisani 1946. kod radnika u Massachusettsu, u proizvodnji fluorescentnih svjetiljki. [21]
S berilijem i njegovim spojevima, treba rukovati vrlo pažljivo, da ne bi došlo do oslobađanja berilijeve prašine, jer duže izlaganje toj prašini može izazvati rak pluća. Testiranje berilija u zraku se vrši prema standardima ASTM D7202 i ASTM D7458. Prvi postupak koristi razblaženu otopinu amonij bifluorida (NH4HF2 ili NH4F•HF.) za otapanje i fluorescentno otkrivanje, metoda koja je 100 puta osjetljivija od preporučenih količina berilija na radnom mjestu. [22] [23]
Izvori[uredi | uredi kod]
- ↑ „Berilioza”. Arhivirano iz originala na datum 2015-03-24. Pristupljeno 2015-02-18.
- ↑ "Landolt-Börnstein Group VIII Advanced Materials and Technologies: Powder Metallurgy Data. Refractory, Hard and Intermetallic Materials" Behrens, V., 2003.
- ↑ [1] "Beryllium its Metallurgy and Properties" Henry H. Hausner
- ↑ Whitehead, N; Endo, S; Tanaka, K; Takatsuji, T; Hoshi, M; Fukutani, S; Ditchburn, Rg; Zondervan, A. "A preliminary study on the use of (10)Be in forensic radioecology of nuclear explosion sites"
- ↑ [2] "How to Change Nuclear Decay Rates" Bill Johnson, 2008.
- ↑ [3] "Supernovae and nucleosynthesis" Arnett David, 1996.
- ↑ "A new inner vertex detector for STAR" 2001., Wieman, H.
- ↑ [4] "Metals handbook" Joseph R. Davis, 1998.
- ↑ [5] "Encyclopedia of materials, parts, and finishes" Mel M. Schwartz, 2002.
- ↑ [6] "Defence forces face rare toxic metal exposure risk"
- ↑ "The James Webb Space Telescope" Jonathan P. Gardner, 2007. [7]
- ↑ "The Spitzer Space Telescope Mission" M. W. Werner, 2004., Roellig T. L., Low F. J.
- ↑ [8] "Understanding anesthesia equipment" Dorsch Jerry A., Dorsch Susan, 2007.
- ↑ [9] "How nuclear weapons spread" Barnaby Frank, 1993.
- ↑ [10] Arhivirano 2009-01-06 na Wayback Machine-u John E. Johnson, Jr., 2007. "Usher Be-718 Bookshelf Speakers with Beryllium Tweeters"
- ↑ [11] 2010., "Beryllium use in pro audio Focal speakers"
- ↑ [12] Arhivirano 2010-02-10 na Wayback Machine-u 2009., "Exposé E8B studio monitor"
- ↑ [13] "High-power diode lasers" Diehl Roland, 2000.
- ↑ [14] 2005., "Purdue engineers create safer, more efficient nuclear fuel, model its performance"
- ↑ Breslin AJ. "in Beryllium: Its Industrial Hygiene Aspects" 1966.
- ↑ [15] "Photograph of Chicago Pile One Scientists 1946" 2006.Office of Public Affairs, Argonne National Laboratory
- ↑ [16] ASTM D7458 –08
- ↑ "Development of a New Fluorescence Method for the Detection of Beryllium on Surfaces" 2005., Minogue EM., Ehler DS.
| H | He | ||||||||||||||||||||||||||||||
| Li | Be | B | C | N | O | F | Ne | ||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | ||||||||||||||||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | As | Br | Kr | ||||||||||||||||
| Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Te | I | Xe | |||||||||||||||
| Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Rn | ||
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Uut | Uuq | Uup | Uuh | Uus | Uuo |
| Alkalijski metali | Zemnoalkalijski metali | Lantanoidi | Aktinoidi | Prijelazni metali | Slabi metali | Polumetali | Nemetali | Halogeni elementi | Plemeniti plinovi |