Fenolftalein – razlika između verzija
Nova stranica: {{chembox | verifiedrevid = 267025533 |ImageFile=Phenolphthalein-low-pH-2D-skeletal.svg |ImageSize= |IUPACName=3,3-bis(4-hydroxyphenyl)isobenzofuran-1(3''H'')-one |OtherNames= |Sec... |
Nema sažetka izmjene |
||
| Red 18: | Red 18: | ||
| MolarMass= |
| MolarMass= |
||
| Appearance= |
| Appearance= |
||
| Density=1.277 g cm<sup>−3</sup>, at 32 ° |
| Density=1.277 g cm<sup>−3</sup>, at 32 °C |
||
| MeltingPt=262.5 ° |
| MeltingPt=262.5 °C |
||
| BoilingPt=N/A |
| BoilingPt=N/A |
||
| Solubility = Nerastvoran |
| Solubility = Nerastvoran |
||
| Solvent = Drugi rastvarači |
| Solvent = Drugi rastvarači |
||
| SolubleOther = Nerastvoran u [[benzen]]u, veoma rastvoran u [[etanol]]u i [[etar|etru]], u manjoj meri u |
| SolubleOther = Nerastvoran u [[benzen]]u, veoma rastvoran u [[etanol]]u i [[etar|etru]], u manjoj meri u [[DMSO]] |
||
}} |
}} |
||
|Section3= {{Chembox Hazards |
|Section3= {{Chembox Hazards |
||
| Red 32: | Red 32: | ||
}} |
}} |
||
'''Fenolftalein''' je [[hemijsko jedinjenje]] sa [[hemijska formula|formulom]] |
'''Fenolftalein''' je [[hemijsko jedinjenje]] sa [[hemijska formula|formulom]] [[ugljenik|C]]<sub>20</sub>[[vodonik|H]]<sub>14</sub>[[kiseonik|O]]<sub>4</sub>. On se često označava sa "'''HIn'''" ili "'''phph'''". Često se koristi u [[titracija]]ma, on je bezbojan u [[kiselina|kiselim]] rastvorima i roze u [[Baza (hemija)|baznim]] rastorima.<ref>{{RajkovićAnalitičkaHemija}}</ref> Ako je koncentracija indikatora posebno jaka, on može da izgleda ljubičasto. |
||
U jakim baznim rastvorima, fenolftalein roze boja podleže prilično sporoj reakciji izbleđavanja i on ponovo postaje bezbojan. Ovaj molekul ima četiri forme: |
U jakim baznim rastvorima, fenolftalein roze boja podleže prilično sporoj reakciji izbleđavanja i on ponovo postaje bezbojan. Ovaj molekul ima četiri forme: |
||
{| class="wikitable" style="margin: 1em auto 1em auto; text-align: center;" |
{| class="wikitable" style="margin: 1em auto 1em auto; text-align: center;" |
||
! Vrste |
! Vrste |
||
| |
| In<sup>+</sup> || H<sub>2</sub>In</center> || In<sup>2−</sup> || In(OH)<sup>3−</sup> |
||
|- |
|- |
||
! Struktura |
! Struktura |
||
| Red 45: | Red 45: | ||
| [[Datoteka:Phenolphthalein-orange-very-low-pH-3D-balls.png|100px]] || [[Datoteka:Phenolphthalein-colourless-low-pH-3D-balls.png|100px]] || [[Datoteka:Phenolphthalein-red-mid-pH-3D-balls.png|100px]] || [[Datoteka:Phenolphthalein-colourless-high-pH-3D-balls.png|100px]] |
| [[Datoteka:Phenolphthalein-orange-very-low-pH-3D-balls.png|100px]] || [[Datoteka:Phenolphthalein-colourless-low-pH-3D-balls.png|100px]] || [[Datoteka:Phenolphthalein-red-mid-pH-3D-balls.png|100px]] || [[Datoteka:Phenolphthalein-colourless-high-pH-3D-balls.png|100px]] |
||
|- |
|- |
||
! |
! [[PH vrednost|pH]] |
||
| <0 || 0−8.2 || 8.2−12.0 || >12.0 |
| <0 || 0−8.2 || 8.2−12.0 || >12.0 |
||
|- |
|- |
||
| Red 69: | Red 69: | ||
{|- cellpadding="10" cellspacing="5" style="margin:5px; border:1px solid;" align=left |
{|- cellpadding="10" cellspacing="5" style="margin:5px; border:1px solid;" align=left |
||
| align=center colspan="3" style="background:#efefef;" | '''Fenolftalein''' ([[pH indikator| |
| align=center colspan="3" style="background:#efefef;" | '''Fenolftalein''' ([[pH indikator|pH indikator]]) |
||
|- |
|- |
||
|align=center| ''ispod |
|align=center| ''ispod pH 8.2'' |
||
| |
| |
||
|align=center| ''iznad |
|align=center| ''iznad pH 10.0'' |
||
|- |
|- |
||
|align=center bgcolor=white| '''bezbojan''' |
|align=center bgcolor=white| '''bezbojan''' |
||
Verzija na datum 2 april 2014 u 03:58
| Fenolftalein | |||
|---|---|---|---|
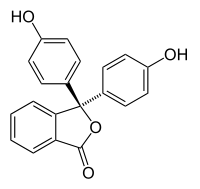
| |||
| IUPAC ime |
| ||
| Identifikacija | |||
| CAS registarski broj | 77-09-8 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| Svojstva | |||
| Molekulska formula | C20H14O4 | ||
| Molarna masa | 318.32 g mol−1 | ||
| Gustina | 1.277 g cm−3, at 32 °C | ||
| Tačka topljenja |
262.5 °C | ||
| Tačka ključanja |
N/A | ||
| Rastvorljivost u vodi | Nerastvoran | ||
| Rastvorljivost u Drugi rastvarači | Nerastvoran u benzenu, veoma rastvoran u etanolu i etru, u manjoj meri u DMSO | ||
|
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Fenolftalein je hemijsko jedinjenje sa formulom C20H14O4. On se često označava sa "HIn" ili "phph". Često se koristi u titracijama, on je bezbojan u kiselim rastvorima i roze u baznim rastorima.[1] Ako je koncentracija indikatora posebno jaka, on može da izgleda ljubičasto.
U jakim baznim rastvorima, fenolftalein roze boja podleže prilično sporoj reakciji izbleđavanja i on ponovo postaje bezbojan. Ovaj molekul ima četiri forme:
| Vrste | In+ | H2In | In2− | In(OH)3− |
|---|---|---|---|---|
| Struktura |  |
 |
 |

|
| Model |  |
 |
 |

|
| pH | <0 | 0−8.2 | 8.2−12.0 | >12.0 |
| Uslovi | jako kiselo | kiselo ili blizo-neutralnom | bazno | jako bazno |
| Boja | narandžasta | bezbojno | roze | bezbojno |
| Slika |  |
 |
Sinteza
Fenolftalein se sintetiše kondenzacijom ftalnog anhidrida sa dva ekvivalenta fenola pod kiselim uslovima. Ovu reakciju je otkrio 1871. godine Adolf fon Bajer.
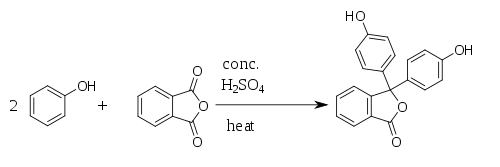
Upotreba
Fenolftalein je indikator koji menja boju u odnosu na sredinu. Ako je sredina kisela, on neće promeniti boju (ostaće bezbojan), a ako je sredina bazna, menjaće boju u ljubičasto.
| Fenolftalein (pH indikator) | ||
| ispod pH 8.2 | iznad pH 10.0 | |
| bezbojan | ⇌ | fuksija |
Fenolftalein je bio korišten duže od jednog veka kao laksativ, ali se sad uklanja sa tržišta laksativa[2] zbog zabrinutosti oko karcinogenosti.[3][4]
Reference
- ↑ Rajković M. B. i saradnici (1993). Analitička hemija. Beograd: Savremena administracija.
- ↑ Spiller, Ha; Winter, Ml; Weber, Ja; Krenzelok, Ep; Anderson, Dl; Ryan, Ml (May 2003), „Skin breakdown and blisters from senna-containing laxatives in young children”, The Annals of pharmacotherapy 37 (5): 636–9, DOI:10.1345/aph.1C439, ISSN 1060-0280, PMID 12708936
- ↑ June K. Dunnick and James R. Hailey (November 1, 1996), „Phenolphthalein Exposure Causes Multiple Carcinogenic Effects in Experimental Model Systems”, Cancer Research 56 (21): 4922–4926, PMID 8895745
- ↑ Tice, Rr; Furedi-Machacek, M; Satterfield, D; Udumudi, A; Vasquez, M; Dunnick, Jk (1998), „Measurement of micronucleated erythrocytes and DNA damage during chronic ingestion of phenolphthalein in transgenic female mice heterozygous for the p53 gene.”, Environmental and molecular mutagenesis 31 (2): 113–24, DOI:10.1002/(SICI)1098-2280(1998)31:2<113::AID-EM3>3.0.CO;2-N, ISSN 0893-6692, PMID 9544189
