Proteinska kinaza
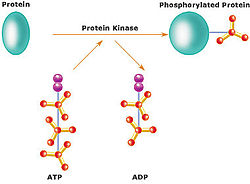
Proteinska kinaza je kinaza koja modifikuje druge proteine putem hemijskog dodavanja fosfatnih grupa na njih (fosforiliacijom). Fosforilacija obično rezultira u funkcionalnoj promeni ciljnog proteina (supstrata) usled promene enzimske aktivnosti, ćelijske lokacije, ili vezivanja za druge proteine. Humani genom sadrži oko 500 gena proteinskih kinaza i one sačinjavaju oku 2% svih ljudskih gena.[1] Proteinske kinaze su takođe prisutne kod bakterija i biljki. Do 30% od postojećih ljudskih proteina može biti modifikovano dejstvom kinaza. Poznato je da one regulišu većinu ćelijskih puteva, posebno one koji učestvuju u prenosu signala.
Hemijska aktivnost[uredi | uredi kod]
Hemijska aktivnost kinaze se sastoji od transfera fosfatne grupe sa nukleozid trifosfata (obično ATP) i njegovog kovalentnog vezivanje na jednu od tri aminokiseline koje imaju slobodnu hidroksilnu grupu. Većina kinaza deluje na obe serin i treonin, druge deluju na tirozin, i neke od njih (dualno-specifične kinaze) deluju na sva tri aminokiselinska ostatka.[2] Postoje takođe proteinske kinaze koje fosforilišu druge aminokiseline, npr. histidinske kinaze koje fosforilišu histidinski ostatak.[3]
Regulacija[uredi | uredi kod]
Proteinske kinaze imaju sveobuhvatni i suštinski uticaj na ćelije, i stoga je njihova aktivnost strogo regulisana. Kinaze se uključuju i isključuju fosforilacijom (u nekim slučajevima samom kinazom - cis-fosforilacija/autofosforilacija), vezivanjem enzimskih aktivatora ili inhibitora, ili malih molekula, ili putem kontrolisanja njihove lokacije u ćeliji relativno na njihove supstrate.
Struktura[uredi | uredi kod]
Katalitičke podjedinice mnogih proteinskih kinaza su visoko konzervirane, i znatan broj struktura je rešen.[4]
Eukariotske proteinske kinaze su enzimi koji pripadaju velikoj familiji proteina koja deli konzervirani katalitički domen.[5][6][7][8] Postoji više konzerviranih regiona u katalitičkom domenu proteinskih kinaza. U N-terminusu katalitičkog domena postoji glicinom-bogat segment u blizini aminokiseline lizin za koji je bilo pokazano da učestvuje u ATP vezivanju. U centralnom delu katalitičkoj domena, nalazi se konzervirana asparaginska kiselina, koja je važna za katalitičku aktivnost.[9]
Grupe proteinskih kinaza[uredi | uredi kod]
Familija humanih proteinskih kinaza se deli u sledeće grupe:
- AGC kinaza - obuhvata PKA, PKC i PKG.
- CaM kinaza - sadrži kalcijum/kalmodulin-zavisne proteinske kinaze.
- CK1 - sadrži kazein kinaza 1 grupu.
- CMGC - sadrži CDK, MAPK, GSK3 i CLK kinaze.
- STE - sadrži homologe kvaščane Sterile 7, Sterile 11, i Sterile 20 kinaze.
- TK - sadrži tirozinske kinaze.
- TKL - sadrži tirozinskim-kinazama sličnu grupu kinaza.
Literatura[uredi | uredi kod]
- Nicholas C. Price, Lewis Stevens (1999). Fundamentals of Enzymology: The Cell and Molecular Biology of Catalytic Proteins (Third izd.). USA: Oxford University Press. ISBN 019850229X.
- Eric J. Toone (2006). Advances in Enzymology and Related Areas of Molecular Biology, Protein Evolution (Volume 75 izd.). Wiley-Interscience. ISBN 0471205036.
- Branden C, Tooze J.. Introduction to Protein Structure. New York, NY: Garland Publishing. ISBN: 0-8153-2305-0.
- Irwin H. Segel. Enzyme Kinetics: Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems (Book 44 izd.). Wiley Classics Library. ISBN 0471303097.
- Robert A. Copeland (2013). Evaluation of Enzyme Inhibitors in Drug Discovery: A Guide for Medicinal Chemists and Pharmacologists (2nd izd.). Wiley-Interscience. ISBN 111848813X.
- Gerhard Michal, Dietmar Schomburg (2012). Biochemical Pathways: An Atlas of Biochemistry and Molecular Biology (2nd izd.). Wiley. ISBN 0470146842.
- ↑ Manning G, Whyte DB. et al. (2002). „The protein kinase complement of the human genome”. Science 298 (5600): 1912–1934. DOI:10.1126/science.1075762. PMID 12471243.
- ↑ Dhanasekaran N, Premkumar Reddy E (September 1998). „Signaling by dual specificity kinases”. Oncogene 17 (11 Reviews): 1447–55. DOI:10.1038/sj.onc.1202251. PMID 9779990.
- ↑ Besant PG, Tan E, Attwood PV (March 2003). „Mammalian protein histidine kinases”. Int. J. Biochem. Cell Biol. 35 (3): 297–309. DOI:10.1016/S1357-2725(02)00257-1. PMID 12531242.
- ↑ Stout TJ, Foster PG, Matthews DJ (2004). „High-throughput structural biology in drug discovery: protein kinases”. Curr. Pharm. Des. 10 (10): 1069–82. DOI:10.2174/1381612043452695. PMID 15078142. Arhivirano iz originala na datum 2012-12-09. Pristupljeno 2021-08-10.
- ↑ Hanks SK (2003). „Genomic analysis of the eukaryotic protein kinase superfamily: a perspective”. Genome Biol. 4 (5): 111. DOI:10.1186/gb-2003-4-5-111. PMC 156577. PMID 12734000. Arhivirano iz originala na datum 2015-04-19. Pristupljeno 2014-01-25.
- ↑ Hanks SK, Hunter T (May 1995). „Protein kinases 6. The eukaryotic protein kinase superfamily: kinase (catalytic) domain structure and classification”. FASEB J. 9 (8): 576–96. PMID 7768349.
- ↑ Hunter T (1991). „Protein kinase classification”. Meth. Enzymol. 200: 3–37. DOI:10.1016/0076-6879(91)00125-G. PMID 1835513.
- ↑ Hanks SK, Quinn AM (1991). „Protein kinase catalytic domain sequence database: identification of conserved features of primary structure and classification of family members”. Meth. Enzymol. 200: 38–62. DOI:10.1016/0076-6879(91)00126-H. PMID 1956325.
- ↑ Knighton DR, Zheng JH, Ten Eyck LF, Ashford VA, Xuong NH, Taylor SS, Sowadski JM (July 1991). „Crystal structure of the catalytic subunit of cyclic adenosine monophosphate-dependent protein kinase”. Science (journal) 253 (5018): 407–14. DOI:10.1126/science.1862342. PMID 1862342.
Spoljašnje veze[uredi | uredi kod]
- Proteinske kinaze[mrtav link]
- Humane i mišje proteinske kinaze: klasifikacija i indeks Arhivirano 2011-04-30 na Wayback Machine-u
- Kinase.Com Arhivirano 2020-12-26 na Wayback Machine-u
- Kinaze/TIP Arhivirano 2013-05-12 na Wayback Machine-u
- AurSCOPE Kinase Database Arhivirano 2011-05-06 na Wayback Machine-u
- Kinasecentral Arhivirano 2008-06-09 na Wayback Machine-u
- Kolekcija Ser/Thr/Tyr specifičnih proteinskih kinaza Arhivirano 2004-06-13 na Wayback Machine-u
- KinMutBase: registar bolest-izazivajućih mutacija u domenu proteinskih kinaza Arhivirano 2006-05-02 na Wayback Machine-u
- Humani kinom
- UMich orijentacija proteina u membranama families/superfamily-63 - Orijentacije C1 domena
- UMich orijentacija proteina u membranama families/superfamily-47 - Orijentacije C2 domena