terc-Butanol
| terc-Butanol | |||
|---|---|---|---|
 |
 | ||

| |||
| IUPAC ime |
| ||
| Drugi nazivi | terc-Butil alkohol[1] 2-Metil-2-propanol[1] | ||
| Identifikacija | |||
| CAS registarski broj | 75-65-0 | ||
| PubChem[2][3] | 6386 | ||
| ChemSpider[4] | 6146 | ||
| UNII | MD83SFE959 | ||
| EINECS broj | |||
| UN broj | 1120 | ||
| DrugBank | DB03900 | ||
| MeSH | |||
| ChEBI | 45895 | ||
| ChEMBL[5] | CHEMBL16502 | ||
| RTECS registarski broj toksičnosti | EO1925000 | ||
| Bajlštajn | 906698 | ||
| Gmelin Referenca | 1833 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | C4H10O | ||
| Molarna masa | 74.12 g mol−1 | ||
| Agregatno stanje | Bezbojna tečnost | ||
| Miris | Miris kamfora | ||
| Gustina | 0,775 g/mL | ||
| Tačka topljenja |
25-26 °C, 298-299 K, 77-79 °F | ||
| Tačka ključanja |
82-83 °C, 355-356 K, 179-181 °F | ||
| log P | 0,584 | ||
| Napon pare | 4,1 kPa (na 20 °C) | ||
| Indeks prelamanja (nD) | 1,387 | ||
| Termohemija | |||
| Standardna entalpija stvaranja jedinjenja ΔfH |
−360,04–−358,36 kJ mol−1 | ||
| Std entalpija sagorevanja ΔcH |
−2,64479–−2,64321 MJ mol−1 | ||
| Standardna molarna entropija S |
189,5 J K−1 mol−1 | ||
| Specifični toplotni kapacitet, C | 215,37 J K−1 mol−1 | ||
| Opasnost | |||
| Podaci o bezbednosti prilikom rukovanja (MSDS) | inchem.org | ||
| EU-klasifikacija | |||
| EU-indeks | 603-005-00-1 | ||
| NFPA 704 | |||
| R-oznake | R11, R20, R36/37 | ||
| S-oznake | S2, S9, S16, S46 | ||
| Tačka paljenja | 11 °C | ||
| Tačka spontanog paljenja | 480 °C | ||
| Eksplozivni limiti | 2,4–8,0% | ||
| Srodna jedinjenja | |||
| Srodna butanoli | 2-Butanol | ||
| Srodna jedinjenja | 2-Metil-2-butanol | ||
|
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
terc-Butanol (2-metil-2-propanol) je najjednostavniji tercijarni alkohol. On je jedan od četiri izomera butanola. terc-Butanol je prozirna tečnost (ili bezbojna tečnost) sa mirisom sličnog kamforu. On je veoma rastvoran u vodi i meša se sa etanolom i etrom. On je jedinstven među izomerima butanola, jer je obično čvrst na sobnoj temperaturi, sa tačkom topljenja koja je malo iznad 25 °C.
Tercijarni alkohol, terc-butanol je stabilniji u pogledu oksidacije i manje je reaktivan od drugih izomera butanola.
Kad se terc-butanol deprotonizuje sa jakom bazom, produkt je alkoksidni anjon. U ovom slučaju, to je terc-butoksid. Na primer, široko korišteni organski reagens kalijum terc-butoksid se priprema reakcijom suvog terc-butanola sa kalijumom.[6]
- K + tBuOH → tBuO−K+ + 1/2 H2
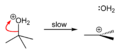
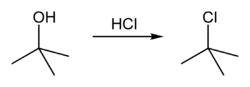
terc-Butanol reaguje sa hlorovodonikom da formira terc-butil hlorid i vodu putem SN1 mehanizma.
-
Korak 1
-
Korak 2
-
Korak 3
Sveukupna reakcija je stoga:
Pošto je terc-butanol tercijarni alkohol, relativna stabilnost terc-butil karbokatjona u koraku 2 omogućava SN1 mehanizam. Primarni alkoholi generalno podležu SN2 mehanizmu jer je relativna stabilnost primarnog karbokatjonskog intermedijaar veoma niska. Tercijarni karbokatjon je u ovom slučaju stabilizovan putem hiperkonjugacijek, pri čem susedne C–H sigma veze doniraju elektrone u praznu p-orbitalu karbokatjona.
- ↑ 1,0 1,1 1,2 „tert-Butyl Alcohol - Compound Summary”. PubChem Compound. National Center for Biotechnology Information. 26. 03. 2005.. Pristupljeno 19. 05. 2012.
- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519.
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846.
- ↑ Gaulton A, Bellis LJ, Bento AP, Chambers J, Davies M, Hersey A, Light Y, McGlinchey S, Michalovich D, Al-Lazikani B, Overington JP. (2012). „ChEMBL: a large-scale bioactivity database for drug discovery”. Nucleic Acids Res 40 (Database issue): D1100-7. DOI:10.1093/nar/gkr777. PMID 21948594.
- ↑ Johnson, W. S.; Schneider, W. P. (1950), „β-Carbethoxy-γ,γ-diphenylvinylacetic acid”, Organic Syntheses 30: 18; Coll. Vol. 4: 132
- Internacionalna karta hemijske bezbednosti 0114
- Nacionalni institut za okupacionu bezbednost i zdravlje (NIOSH) Džepni vodič hemijskih hazarda 0078
- IPCS Ekološki zdravstveni kriterijum 65: Butanols: four isomers