Biosinteza pirimidina
Biosinteza pirimidina je biohemijski proces čiji krajnji proizvodi su purin i urična kiselina, koja je indikator sveukupnog purinskog metabolizma.[1] Kod urikotelnih organizama, pirimidinska biosinteza je glavni put ekstrakcije azota.[2][3][4]
Za razliku od purina, pirimidini su formirani pre njihovog vezivanja za 5-fosforibozil-1-pirofosfat (PRPP).[5]
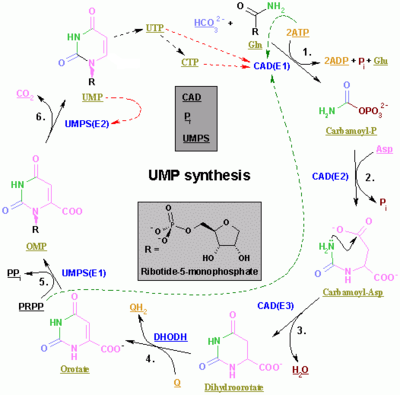
| Enzim | Proizvod | Opis |
| karbamoil fosfat sintetaza II[6] | karbamoil fosfat | Ovo je regulisani korak biosinteze pirimidina. |
| aspartična transkarbamoliaza (aspartat karbamoil transferaza)[6] | karbamoil aspartična kiselina | - |
| dihidroorotaza[6] | dihidroorotat | Dehidracija |
| dihidroorotat dehidrogenaza[7] (mitohondrijski enzim) | orotat | Dihidroorotat onda ulazi u mitohondrije gde je oksidisan putem odstranjivanja vodonika. To je jedini mitohondrijski korak u biosintezi nukleotidnog prstena. |
| orotat fosforiboziltransferaza[8] | OMP | PRPP je korišćen. |
| OMP dekarboksilaza[8] | UMP | Dekarboksilacija |
| uridin-citidin kinaza 2[9] | UDP | Fosforilacija. ATP je korišćen. |
| nukleozid difosfat kinaza | UTP | Fosforilacija. ATP je korišćen. |
| CTP sintetaza | CTP | Glutamin i ATP su korišćeni. |
Prva tre enzima su kodirana istim genom kod Metazoa (CAD). Kod gljiva postoji sličan protein ali mu nedostaje dihidroorotazna funkcija, jedan drugi protein katalizuje drugi korak.
Kod drugih organizama (Bakterija, Archaea i drugih Eukariota), prva tri koraka izvode tri različita enzima.
Pirimidini su na kraju degradirani do CO2, H2O, i ureje. Citozin može biti razložen u uracil koji se dalje razlaže do N-karbamoil-β-alanina. Timin se degradira do β-aminoizobutirata koji se može dalje razložiti u intermedijare koji konačno vode do ciklusa limunske kiselina.[1]
β-aminoizobutirat služi kao grubi indikator stope DNK prometa.[10]
Farmakološka modulacija metabolizma pirimidina ima terapeutsku upotrebu.[11][12]
Inhibitori pirimidin sinteze se koriste u tretmanu umerenog do teškog reumatoidnog artritisa i psoriatskog artritisa. Primeri uključuju leflunomid i teriflunomid.[13][14][15]
- ↑ 1,0 1,1 Donald Voet, Judith G. Voet (2005). „Chapter 28. Nucleotide metabolism”. Biochemistry (3 izd.). Wiley. ISBN 978-0-471-19350-0.
- ↑ Lloyd H. Smith, Jr., M.D. (1973). „Pyrimidine Metabolism in Man”. N Engl J Med 288: 764-771.
- ↑ Gerard A., O'Donovan and Jan Neuhard (1970). „Pyrimidine Metabolism in Microorganisms”. Bacteriological Reviews 34 (3): 278-343.
- ↑ Levine, Rodnez L., Hoogenraad, Nicholas J, Kretchmer, Norma (1974). „A Review: Biological and Clinical Aspects of Pyrimidine Metabolism”. Pediatric Research 8 (7).
- ↑ David L. Nelson, Michael M. Cox (2005). Principles of Biochemistry (4th izd.). New York: W. H. Freeman. ISBN 0-7167-4339-6.
- ↑ 6,0 6,1 6,2 „Entrez Gene: CAD carbamoyl-phosphate synthetase 2, aspartate transcarbamylase, and dihydroorotase”.
- ↑ „Entrez Gene: DHODH dihydroorotate dehydrogenase”.
- ↑ 8,0 8,1 „Entrez Gene: UMPS uridine monophosphate synthetase”.
- ↑ „Entrez Gene: UCK2 uridine-cytidine kinase 2”.
- ↑ Henrik RistNielsen,KaareNyhoim,and Knud-ErikSjøIin (1974). „Relationship between Urinary 3Aminoisobutyric Acid and Transfer RNA Turnover in Cancer Patients'”. Cancer Research 34: 3428-32.
- ↑ Nyhan WL (2005). „Disorders of purine and pyrimidine metabolism”. Mol. Genet. Metab. 86 (1-2): 25–33. DOI:10.1016/j.ymgme.2005.07.027. PMID 16176880.
- ↑ Jurecka A (April 2009). „Inborn errors of purine and pyrimidine metabolism”. J. Inherit. Metab. Dis. 32 (2): 247–63. DOI:10.1007/s10545-009-1094-z. PMID 19291420.
- ↑ Keith Parker; Laurence Brunton; Goodman, Louis Sanford; Lazo, John S.; Gilman, Alfred (2006). „Chapter 52. Immunosuppressants, tolerogens, and immunostimulants; Immunostimulation”. Goodman & Gilman's The Pharmacological Basis of Therapeutics (11 izd.). New York: McGraw-Hill. ISBN 0-07-142280-3.
- ↑ Frieling U, Luger TA (October 2002). „Mycophenolate mofetil and leflunomide: promising compounds for the treatment of skin diseases”. Clin. Exp. Dermatol. 27 (7): 562–70. PMID 12464151.
- ↑ Thomas L. Lemke, David A. Williams, ur. (2002). Foye's Principles of Medicinal Chemistry (5 izd.). Baltimore: Lippincott Willams & Wilkins. str. 785-786. ISBN 0-7817-4443-1.