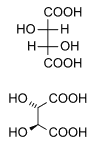
Vinska kiselina
| Vinska kiselina[1] | |||
|---|---|---|---|
| |||

| |||
| IUPAC ime |
| ||
| Drugi nazivi | 2,3-dihidroksisukcinska kiselina trearinska kiselina racemska kiselina uvinska kiselina paratartatna kiselina | ||
| Identifikacija | |||
| CAS registarski broj | 526-83-0 | ||
| PubChem[2][3] | 875 | ||
| ChemSpider[4] | 852 | ||
| MeSH | |||
| Jmol-3D slike | Slika 1 | ||
| |||
| Svojstva | |||
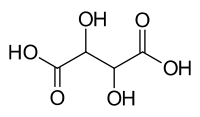
| Molekulska formula | C4H6O6 (Basic formula) HO2CCH(OH)CH(OH)CO2H (Structural formula) | ||
| Molarna masa | 150.087 g/mol | ||
| Agregatno stanje | white powder | ||
| Gustina | 1.79 g/mL (H2O) | ||
| Tačka topljenja |
171–174 °C (L-tartaric) | ||
| Rastvorljivost u vodi | 133 g/100ml (20 °C) | ||
| Opasnost | |||
| EU-klasifikacija | Irritant(Xi) | ||
| R-oznake | R36 | ||
| Srodna jedinjenja | |||
| Drugi katjoni | Monosodium tartrate Disodium tartrate Monopotassium tartrate Dipotassium tartrate | ||
| Srodna karboksilna jedinjenja | Butyric acid Succinic acid Malic acid Maleic acid Fumaric acid | ||
| Srodna jedinjenja | 2,3-Butanediol Cichoric acid | ||
|
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Vinska kiselina je bijela kristalna supstanca koja spada u diprotonske organske kiseline. U prirodi se nalazi u mnogim biljkama kao što je grožđe, banane i tamarindi, i takođe je jedna od glavnih kiselina koje se nalaze u vinu. Dodaje se drugim supstancama kako bi se dobio kiseo ukus, ili se koristi kao antioksidans. Soli vinske kiselina se nazivaju tartarati. Predstavlja dihidroksilni derivat jantarne kiseline.
Prvi put je izolovana iz kalijum-tartarata koji je bio poznat i u antičko vrijeme pod imenom tartar. Moderni proces proizvodnje je razvijen 1769. od strane švedskog hemičara Karla Vilhelma Šilea. Hiralnost vinske kiseline je utvrđena 1832. od strane Žan Baptista Biota koji je posmatrao njenu sposobnost da obrće ravan polarizovane svjetlosti. Luj Paster je nastavio sa ovim istraživanjima 1847. tako što je ispitivao kristale natrijum amonijum tartarata, za koje je otkrio da su asimetrični. Paster je bio prvi koji je dobio vinsku lijeve orjentacije u čistom obliku.
Stereohemija[uredi | uredi kod]

Vinska kiselina je hiralna, i korisna je supstanca u organskoj hemiji za sintezu drugih hiralnih molekula. Oblik vinske kiseline koji se nalazi u prirodi je L-(+) vinska kiselina ili dekstrorotatorna vinska kiselina. Njen enantiomerni oblik tj. slika u ogledalu D-(−) vinska kiselina, i ahiralni mezo oblik mogu biti dobijeni u laboratoriji. (+) i (-) oblik su enantiomeri, a mezo oblik predstavlja diastereoizomer u odnosu na ova dva oblika.
Može se naći i optički neaktivni oblik vinske kiseline, DL oblik je smješa jednakih količina L i D oblika. Nazivana je racemskom kiselinom a taj pojam je kasnije dobio drugo značenje za smješe jednakih količina dva enantiomerna oblika svih jedinjenja - racemate.
Vinska kiselina se koristi da spriječi bakar(II) jone da reaguju sa hidroksilnom grupom koji su prisutni u reagensima bakar(I) oksida. Bakar(I) oksid je crvenkasto smeđa čvrsta supstanca i dobija se redukcijom bakar(II) soli od strane aldehida, i u alkalnom rastvoru.
| levotartaric acid (D-(−)-tartaric acid) |
dextrotartaric acid (L-(+)-tartaric acid) |
mesotartaric acid |
|---|---|---|

|

| |
|
DL-tartaric acid (racemic acid) | ||
Derivati[uredi | uredi kod]

Važni derivati vinske kiseline su njene soli tartarati, kao što je kalijum bitartarat, natrijum kalijum tartarat, antimon kalijum tartarat itd. Diestar vinske kiselina se koristi kao katalizator u hiralnim sintezama.
Vinska kiselina je mišićni toksin, koji djeluje tako što vrši inhibiciju jabučne kiseline. U nižim dozama je neškodljiva i uključena je u sastav raznih vrsta hrane, naročito slatkiša koji imaju kiseo ukus. Nalazi primjenu i kao aditiv u hrani i koristi se kao antioksidant, a tartarati se koriste kao aditivi koji služe kao antioksidanti ili emulgatori.
Kada se kalijum bitartarat pomiješa sa vodom dobije se suspenzija koja se koristi za čišćenje bakarnih novčića, pošto rastvor tartarata može da razgradi sloj bakar(II) oksida koji je prisutan na površini novčića. Dobijen kompleks bakar(II) tartarata je dobro rastvorljiv u vodi.
Vinska kiselina u vinu[uredi | uredi kod]

Vinska kiselina je uzrok stvaranja kristala koji se nekada spontanu stvaraju na pluti. Kristali su po sastavu kalijum bitartarat i podsjećaju na razbijeno staklo.
Vinska kiselina takođe igra važnu hemijsku ulogu tako što snižava pH fermentacije na nivo gdje mnoge bakterije ne mogu da žive, i ponaša se kao konzervans nakon fermentacije. Vinska kiselina daje opor ukus vinu iako tome doprinosi i limunska i jabučna kiselina.
Izvori[uredi | uredi kod]
- ↑ Tartaric Acid - Compound Summary, PubChem.
- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519.
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846.
- ↑ Lide David R., ur. (2006). CRC Handbook of Chemistry and Physics (87th izd.). Boca Raton, FL: CRC Press. 0-8493-0487-3.