Tiofen
| Tiofen | |||
|---|---|---|---|
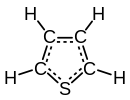 |
 | ||

| |||
| IUPAC ime |
| ||
| Drugi nazivi | Tiofuran Tiaciklopentadien | ||
| Identifikacija | |||
| CAS registarski broj | 110-02-1 | ||
| PubChem[1][2] | 8030 | ||
| ChemSpider[3] | 7739 | ||
| UNII | SMB37IQ40B | ||
| ChEMBL[4] | CHEMBL278958 | ||
| RTECS registarski broj toksičnosti | XM7350000 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | C4H4S | ||
| Molarna masa | 84.14 g/mol | ||
| Agregatno stanje | bezbojna tečnost | ||
| Gustina | 1.051 g/mL, tečnost | ||
| Tačka topljenja |
−38 °C, 235 K, -36 °F | ||
| Tačka ključanja |
84 °C, 357 K, 183 °F | ||
| Indeks prelamanja (nD) | 1.5287 | ||
| Viskoznost | 0.8712 cP na 0.2 °C 0.6432 cP na 22.4 °C | ||
| Opasnost | |||
| Podaci o bezbednosti prilikom rukovanja (MSDS) | External MSDS | ||
| EU-klasifikacija | nije na listi | ||
| NFPA 704 | |||
| Tačka paljenja | −1 °C | ||
| Srodna jedinjenja | |||
| Srodna materija: tioetri | Tetrahidrotiofen Dietil sulfid | ||
| Srodna jedinjenja | Furan Pirol | ||
|
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Tiofen je heterociklično jedinjenje sa formulom C4H4S. On sadrži aromatičan ravan petočlani prsten, i podleže ekstenzivnim reakcijama supstitucije. Srodni tiofenu su benzotiofen i dibenzotiofen, koji sadrže tiofenski prsten spojen sa jednim i dva benzenska prstena, respektivno. Jedinjenja analogna tiofenu su furan (C4H4O) i pirol (C4H4NH).[5][6]
Izolacija, rasprostranjenost[uredi | uredi kod]
Tiofen je nađen kao kontaminant u benzenu.[7] Primećeno je da isatin formira plavu boju kad se pomeša sa sumpornom kiselinom i sirovim benzenom. Za formiranje plavog indofenina se dugo verovalo da je reakcija benzena. Viktor Mejer je uspeo da izoluje supstancu odgovornu za ovu reakciju u benzenu. To novo heterociklično jedinjenje je bio tiofen.[8]
Tiofen i njegovi derivati se javljaju u petroleumu, u pojedinim slučajevima u koncentracijama i do 1-3%. Tiofenski sadržaj petroleuma i uglja se odstranjuje procesom hidrodesulfurizacije (HDS). U HDS, tečni ili gasni materijal se prevodi preko molibdenum disulfidnog katalista p pritiskom H2. Tiofen podleže hidrogenolizi i formiraju se ugljovodonici i vodonik sulfid. Na taj način, tiofen se konvertuje u butan i H2S. Prevalentniji i problematičniji u petroleumu su benzotiofen i dibenzotiofen.
Osobine[uredi | uredi kod]
Na sobnoj temperaturi, tiofen je bezbojna tečnost sa blagim prijatnim mirisom koji podseća na benzen. Visoka reaktivnost tiofena u reakciji sulfonacije je osnova za separaciju tiofena iz benzena, što je teško postići destilacijom usled njihovih sličnih tačaka ključanja (razlikuju se za 4 °C na sobnom pritisku). Poput benzena, tiofen formira azeotrop sa etanolom.
Molekul je ravan; sa uglom veze na sumporu od oko 93 stepena, C-C-S ugao je oko 109, i druga dva ugljenika imaju ugao veze od oko 114 stepeni. C-C veze ugljenika susednih sumporu su oko 1.34A, C-S veza je duga oko 1.70A, i druga C-C veza je oko 1.41A.
Reaktivnost[uredi | uredi kod]
Tiofen se smatra aromatičnim, mada teorijske kalkulacije sugeriraju da je njegov stepen aromatičnosti manji od benzena. Elektronski parovi sumpora su znatno delokalizovani u pi elektronskom sistemu. Posledica njegove aromatičnosti je da tiofen ne manifestuje osobine konvencionalnih tioetara. Na primer atom sumpora je otporan na alkilaciju i oksidaciju.
Literatura[uredi | uredi kod]
- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519.
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846.
- ↑ Gaulton A, Bellis LJ, Bento AP, Chambers J, Davies M, Hersey A, Light Y, McGlinchey S, Michalovich D, Al-Lazikani B, Overington JP. (2012). „ChEMBL: a large-scale bioactivity database for drug discovery”. Nucleic Acids Res 40 (Database issue): D1100-7. DOI:10.1093/nar/gkr777. PMID 21948594.
- ↑ Clayden Jonathan, Nick Greeves, Stuart Warren, Peter Wothers (2001). Organic chemistry. Oxford, Oxfordshire: Oxford University Press. ISBN 0-19-850346-6.
- ↑ Katritzky A.R., Pozharskii A.F. (2000). Handbook of Heterocyclic Chemistry. Academic Press. ISBN 0080429882.
- ↑ Viktor Meyer (1883). „Ueber den Begleiter des Benzols im Steinkohlenteer”. Berichte der Deutschen chemischen Gesellschaft 16: 1465–1478. DOI:10.1002/cber.188301601324.
- ↑ Ward C. Sumpter (1944). „The Chemistry of Isatin”. Chemical Reviews 34 (3): 393–434. DOI:10.1021/cr60109a003.
