Karbonil

U organskoj hemiji, karbonilna grupa je familija funkcionalnih grupa koje se sastoje od ugljenikovog atoma dvostruko-vezanog za kiseonikov atom: C=O.[1]
Termin karbonil se takođe može odnositi na ugljen-monoksid kao ligand u neorganskim ili organometalnim kompleksima (metalni karbonil, npr. nikl-tetrakarbonil).
Karbonilna grupa karakteriše sledeće tipove jedinjenja:
| Jedinjenje | Aldehid | Keton | Karboksilna kiselina | Estar | Amid | Enon | Acil halid | Acil anhidrid |
| Struktura |  |
 |
 |
 |
 |

| ||
| Generalna formula | RCHO | RCOR' | RCOOH | RCOOR' | RCONR'R'' | RC(O)C(R')CR''R''' | RCOX | (RCO)2O |
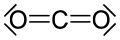
Drugi organski karbonili su ureja i karbamati, derivati acil hlorida: hloroformati i fosgen, karbonatni estri, tioestri, laktoni, laktami, hidroksamati, i izocijanati. Primeri neorganskih karbonilnih jedinjenja su ugljen-dioksid i karbonil-sulfid.
Specijalna grupa karbonilnih jedinjenja su 1,3-dikarbonil jedinjenja koja imaju kisele protone na centralnoj metilenskoj jedinici. Primeri su meldrumska kiselina, dietil malonat i acetilaceton.

Kiseonik je elektronegativniji od ugljenika, tako da odvlači elektronsku gustinu sa ugljenika čime povećava polarnost veze. Karbonilni ugljenik postaje elektrofilan, i stoga lakše reaguje sa nukleofilima. Isto tako, elektronegativni kiseonik može da reaguje sa elektrofilima; na primer sa protonom iz kiselog rastvora ili drugim Luisovim kiselinama.
Alfa vodonici karbonilnog jedinjenja su znatno kiseliji (~103 puta kiseliji) nego u vodonici tipične C-H veze. Na primer, pKa vrednosti acetaldehida i acetona su 16.7 i 19, respektivno.[2] Karbonil je u tautomernoj rezonanci sa enolom. Deprotonacija enola jakom bazom proizvodi enolat, koji je snažan nukleofil i može da alkiluje elektrofile kao što su drugi karbonili.
- ↑ Clayden Jonathan, Nick Greeves, Stuart Warren, Peter Wothers (2001). Organic chemistry. Oxford, Oxfordshire: Oxford University Press. ISBN 0-19-850346-6.
- ↑ Ouellette, R.J. and Rawn, J.D. “Organic Chemistry” 1st Ed. Prentice-Hall, Inc., 1996: New Jersey. ISBN 0-02-390171-3.
- L.G. Wade, Jr. Organic Chemistry, 5th ed. Prentice Hall, 2002. ISBN 0-13-033832-X
- The Frostburg State University Chemistry Department. Organic Chemistry Help (2000).
- Advanced Chemistry Development, Inc. IUPAC Nomenclature of Organic Chemistry (1997).
- William Reusch. tara VirtualText of Organic Chemistry (2004).
- Purdue Chemistry Department [1] (retrieved Sep 2006). Includes water solubility data.
- William Reusch. (2004) Aldehydes and Ketones Arhivirano 2002-09-17 na Wayback Machine-u, Pristupljeno 23. 5. 2005.
- ILPI. (2005) The MSDS Hyperglossary- Anhydride.

