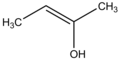
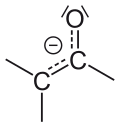
Enol
Enoli (alkenoli) su alkeni sa hidroksilnom grupom na jednom od ugljenikovih atoma dvostruke veze. Alkeni sa hidroksilnim grupama na obe strane dvostruke veze se nazivaju endioli. Deprotonisani anjoni enola su enolati. Redukton je jedinjenje koje ima endiolnu strukturu sa susednom karbonilnom grupom.
C=C dvostruka veza sa susednim alkoholom daje enolima i endiolima njihove hemijske karakteristike. Oni ispoljavaju keto-enolni tautomerizam. U keto-enolnom tautomerizmu, enoli se inter-konvertuju sa ketonima ili aldehidima.
Reči enol i alkenol su formirane od reči "alken" (ili samo -en, sufiks jedinjenja sa C=C dvostrukom vezom) i "alkohol" (koja predstavlja enolsku hidroksilnu grupu).

Levo je keto forma
Enoli se inter-konvertuju sa karbonilnim jedinjenjima koja imaju α-vodonik, kao što su ketoni i aldehidi. Jedinjenje je deprotonisano na jednoj strani i protonisano na drugoj strani, dok se jednostruka i dvostruka veza zamenjuju. To se zove keto-enolni tautomerizam.
Enolni oblik je obično nestabilan, ne opstaje dugo, nego prelazi u keto oblik (keton). To je događa zato što je kiseonik elektronegativniji nego ugljenik i zato formira jaču vezu.


Kod 1,3-dikarbonil i 1,3,5-trikarbonil jedinjenja (mono-)enolni oblik je predominantan. To je prouzrokovano intra-molekularnom vodoničnim vezivanjem i mogućnošću lakog internog protonskog transfera.[1]
Iz tog razloga u ekvilibrijumu preko 99% propandial (OHCCH2CHO) molekula postoji kao mono-enol. Procenat je niži kod 1,3-aldehid ketona i diketona (acetilaceton, na primer, je 80 % u enolnoj formi).
Kad dođe do keto-enolnog tautomerizma keto ili enol su deprotonisani i anjon (enolat) se formira kao intermedijar. Kod enolata anjonski naboj je delokalizovan preko kiseonika i ugljenika[2]. To je fenomen poznat kao rezonanca. Enolati su u određenoj meri stabilizovani rezonancom. Enolati mogu da postoje u kvantitativnim količinama u striktnom odsustvu Brenstedovih kiselinskih uslova, pošto su oni generalno veoma bazni.
| Keto-enolni-tautomerizam | |||||
|---|---|---|---|---|---|

|
 
|

| |||
| Inter-konverzacija između keto forme i enolata; deprotonacija α-C-atoma. |
Enolatni anjon, ispoljava rezonancu. Levo je karbanjon. |
Inter-konverzija između enolata i enola; protonacija enolata. | |||

Kod ketona (tipa karbonila) sa kiselim α-vodonikom na bilo kojoj strani karbonilnog ugljenika, selektivnost deprotonacije se može postići stvaranjem enolata iz ketona. Na niskim temperaturama (-78 °C, npr. u kupatilu sa suvim ledom), u aprotičnim solventima, i sa glomaznim ne-uravnotežavajućim bazama (npr. LDA) "kinetički" proton se može odstraniti. "Kinetički" proton onaj koji je sterički najpristupačniji. Pod termodinamičkim uslovima (više temperature, slaba baza, i protički rastvarač) ekvilibrijum je uspostavljen između ketona i dva moguća enolata. Povlašćeni enolat se naziva "termodinamički" enolat i on je povlašćen zato što on ima niži energetski nivo nego drugi mogući enolat. Na taj način, birajući optimalne uslove za stvaranje enolata, moguće je povećati prinos željenog produkta dok se minimizuje formacija neželjenog produkta.

Endioli su alkeni sa hidroksilnom grupom sa obe strane C=C dvostruke veze. Endioli su reakcioni intermedijari Lobry-de Bruyn-van Ekenstein transformacije.

Endioli sa karbonilnom grupom susednom endiolnoj grupi se nazivaju reduktoni. Endiolna struktura je stabilizovana rezonancom, koja rezultira iz tautomerizma sa susednim karbonilom. In tog razloga, hemijski ekvilibrijum proizvodi uglavnom endiolnu formu umesto keto forme. Reduktoni su jako redukujući agenti, efikasni antioksidanti, i prilično jake kiseline.[3]
Primeri reduktona su tartronaldehid, reduktonska kiselina i askorbinska kiselina.
| Primeri reduktona | ||
|---|---|---|
 |
 |

|
| Tartronaldehid | Reduktonska kiselina | Askorbinska kiselina (Vitamin C) |
- ↑ W. Caminati, J.-U. Grabow (2006). „The C2v Structure of Enolic Acetylacetone”. Journal of the American Chemical Society 128 (3): 854–857. DOI:10.1021/ja055333g.
- ↑ IUPAC Gold Book enolates
- ↑ IUPAC Gold Book reductones