Ugljikov ciklus
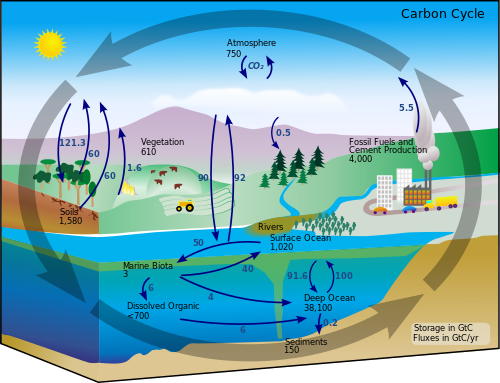



Ugljikov ciklus je biogeokemijski ciklus, u kojem se ugljik izmjenjuje između biosfere, pedosfere, geosfere, hidrosfere i atmosfere na Zemlji. To je jedan od najvažnijih ciklusa na Zemlji i omogućuje da ugljik ponovno iskoriste novi organizmi.
Ugljikov ciklus je otkrio Antoine Lavoisire i Joseph Priestley, a kasnije je razvio Humphry Davy.[1] Ugljikov ciklus uključuje sljedeće glavne spremnike ugljika:
- Zemljinu atmosferu
- Zemljinu biosferu, koja obično uključuje sisteme slatke vode i nežive organske materijale, kao što je ugljik u tlu.
- oceane, uključujući otopljeni anorganski ugljik, te sve žive i nežive morske organizme
- sedimente, uključujući fosilna goriva
- Zemljina unutrašnjost, a to se odnosi na ugljik koji se nalazi u Zemljinoj kori i plaštu, a ispušta se u atmosferu i hidrosferu preko vulkana i geotermalnih izvora
Godišnje kretanje ugljika ili izmjena između spremnika, se javlja zbog različitih kemijskih, geoloških i bioloških procesa. Ocean sadrži najveći spremnik ugljika, ali dijelovi u dubokim oceanima se ne izmjenjuju tako brzo s atmosferom.
Proračun svjetskog ugljika je ravnoteža izmjena (ulaza i izlaza) ugljika između raznih spremnika. Taj proračun nam govori da li neki spremnik služi kao izvor ili za taloženje ugljika.
Ugljik u Zemljinoj atmosferi[uredi | uredi kod]
U Zemljinoj atmosferi ugljik prvenstveno postoji kao plin ugljični dioksid (CO2). Iako ga ima samo mali postotak (oko 0,039 %), igra vrlo važnu ulogu u održanju života. Ostali plinovi koji sadrže ugljik su metan i kloroflorougljik (CFC ili freoni – samo zbog ljudskog utjecaja). Stabla, trave i ostale zelene biljke, pretvaraju ugljični dioksid u ugljikohidrate, procesom koji se naziva fotosinteza, oslobađajući kisik u zrak. Taj proces je prilično obilan kod novih šuma, gdje stabla još uvijek rastu. Kod bjelogoričnih šuma je taj proces najjači u proljeće, kad se stvara lišće. To je dobro vidljivo na Keelingovoj krivulji mjerenja koncentracije ugljičnog dioksida. Prevladava najviše na sjevernoj polutci u proljeće, jer južna polutka nema toliko kopna u umjerenom pojasu.
- Šume sadrže 86 % ugljika iznad tla i 73 % ugljika u tlu, na Zemlji. [2]
- Površina oceana prema polovima ima sve više ugljika, jer što je morska voda hladnija, to može otopiti više ugljičnog dioksida iz zraka, pretvarajući je u ugljičnu kiselinu (H2CO3). Značajnu ulogu igra termohalinska pokretna traka, koja prebacuje gušću površinku vodu u unutrašnjost oceana.
- U gornjim područjima oceana, postoji velika biološka produktivnost, organizmi pretvaraju ugljik u tkiva ili karbonate za tvrde zaštitne oklope, kao što su školjke ili puževi. Uglavnom se ugljik taloži prema dolje.
- Razgradnja ugljično-silikatnih stijena. Ugljična kiselina reagira s razgrađenim stijenama i stvara bikarbonatne ione, koje koriste morski organizmi za stvaranje zaštitnog tvrdog sloja. Ovaj ugljik se ne vraća ponovno u atmosferu.
- 1958. je izmjereno u zvjezdarnici Mauna Loa, na Havajima, da ima 0,032 % ugljičnog dioksida, dok je 2010. izmjereno 0,0385 % ugljičnog dioksida u atmosferi. [3]
Ugljik se oslobađa u atmosferu na nekoliko načina:
- preko disanja, koje vrše biljke i životinje. To je eksotermna reakcija, koja oslobađa energiju u obliku topline, a uključuje razbijanje molekula ugljikohidrata na ugljični dioksid i vodu.
- preko raspadanja životinja i biljaka. Gljive i bakterije razlažu ugljikove spojeve kod mrtvih životinja i biljaka, pretvarajući ugljik u ugljični dioksid ili metan.
- preko izgaranja organskih tvari, koje oksidiraju ugljik u ugljični dioksid. Fosilna goriva kao što su nafta, ugljen i prirodni plin, oslobađaju ugljik u obliku ugljičnog dioksida, koji je bio milionima godina spremljen u geosferi. Izgaranja biogoriva isto oslobađa ugljikov dioksid, koji je bio spremljen samo par godina.
- preko proizvodnje cementa. Ugljični dioksid se oslobađa kada se zagrijava vapnenac (CaCO3), da bi se dobilo vapno (CaO), kao sastojak cementa.
- u dijelovima oceana koji su topliji, otopljeni ugljični dioksid se vraća u atmosferu
- vulkanske erupcije i rekristalizacija stijena, oslobađaju plinove u atmosferu. Vulkanski plinovi su prije svega vodena para, ugljični dioksid i sumporov dioksid.
Ugljik u biosferi[uredi | uredi kod]
Ugljik je osnovni sastojak života na Zemlji. Oko polovina suhe težine (bez vode) kod živih organizama je ugljik. Igra važnu ulogu u izgradnji stanične opne, u biokemiji i ishrani svih živih stanica. Živi organizmi sadrže oko 575 x 1012 kg ugljika,[4] od čega najviše imaju stabla. Zemlja ima oko 1 500 x 1012 kg ugljika, uglavnom u obliku organskog ugljika. [5]
- Autotrofi su organizmi koji stvaraju svoju organsku građu, koristeći ugljični dioksid iz zraka ili iz vode u kojoj žive. Za to trebaju vanjsku energiju, a to je uglavnom Sunčeva energija, koja omogućuje fotosintezu. Vrlo mali broj autotrofa koristi kemijsku energiju u procesu kemosinteze. Najvažniji autotrofi su fitoplanktoni u morima i oceanima, te stabla na kopnu. Fotosinteza slijedi kemijsku reakciju: 6CO2 + 6H2O → C6H12O6 + 6O2
- Ugljik se prenosi iz biosfere heterotrofijom, a to je hranjenje na tuđim organizmima ili dijelu organizma. To uključuje gljive ili bakterije koje koriste mrtvi materijal, procesom vrenja ili raspadanjem.
- Većina ugljika napušta biosferu preko staničnog disanja, koje oslobađa ugljični dioksid, kemijskom reakcijom C6H12O6 + 6O2 → 6CO2 + 6H2O. Drugi oblik je nestanično disanje, kojim se oslobada metan u okolinu, atmosferu ili hidrosferu (močvarni plin).
- Izgaranje biomasa (šumski požari, drvo za gorenje) isto oslobađa znatnu količinu ugljičnog dioksida u atmosferu.
- Ugljik može kružiti kroz biosferu kao mrtva tvar (kao treset), koja ostaje u geosferi. Egzoskelet ili kalcijev karbonat iz ljuštura životinja, može postati vapnenac kroz proces sedimentacije.
- Ugljik kruži i u dubokom oceanu, gdje se određene vrste plaštenjaka, koje isto stvaraju tvrdu zaštitu, talože na dnu oceana. [6]
Ugljik u hidrosferi[uredi | uredi kod]
Oceani sadrže oko 36 000 x 1012 kg ugljika, uglavnom u obliku bikarbonatnih iona. Ekstremne oluje, kao što su uragani i tajfuni, talože velike količine ugljika, budući da ispiru velike količine sedimenata. Jedna studija u Tajvanu je izvjestila da je jedan tajfun više isprao ugljika u ocean, nego kiše koje padaju cijelu godinu. Ti bikarbonatni ioni su vrlo važni za uspostavljanje pH vrijednosti u oceanima.
Ugljik se stalno izmjenjuje između oceana i atmosfere. U području uzlaznih struja, ugljik se oslobađa u atmosferu. Suprotno, padaline prenose ugljični dioksid u oceane. Kada ugljični dioksid se otopi u ocean, on slijedi čitav niz kemijskih reakcija, koje su u ravnoteži u određenom dijelu: Otapanje:
- CO2(atmosferski) ⇌ CO2(otopljen)
Pretvaranje u ugljičnu kiselinu:
- CO2(otopljen) + H2O ⇌ H2CO3
Prva ionizacija:
- H2CO3 ⇌ H+ + HCO3− (bikarbonatni ion)
Druga ionizacija:
- HCO3− ⇌ H+ + CO3−− (karbonatni ion)
Ravnoteža tih procesa se ispituje mjerenjima, koja su pokazala da je količina otopljenog ugljika u oceanima oko 10 % količine ugljika u atmosferi. Ako se količina ugljičnog dioksida poveća za 10 % u atmosferi, količina otopljenog ugljika u oceanima se poveća za 1 %. [7]
U oceanima, otopljeni karbonati uglavnom reagiraju s kalcijem, stvarajući kruti kalcijev karbonat ili vapnenac (CaCO3), uglavnom kao zaštitne kućice za mikroskopske organizme. Nakon što ti organizmi uginu, vapnenac se taloži na dnu, što i prestavlja najveći spremnik u ugljikovom ciklusu.
Izvori[uredi | uredi kod]
- ↑ Richard Holmes: "The Age Of Wonder", Pantheon Books, 2008.
- ↑ Sedjo, Roger.1993. "The Carbon Cycle and Global Forest Ecosystem, Water, Air, and Soil Pollution", Oregon Wild Report on Forests, Carbon, and Global Warming)
- ↑ [1] Trends in Carbon Dioxide — NOAA Earth System Research Laboratory
- ↑ [2]
- ↑ "Sequestration of atmospheric CO2 in global carbon pools" Lal Rattan, journal = Energy and Environmental Science, 2008.
- ↑ ""Sinkers" provide missing piece in deep-sea puzzle", publisher=Monterey Bay Aquarium Research Institute MBARI), 2005. [3]
- ↑ Millero Frank: "Chemical Oceanography", publisher=CRC Press, 2005.