Sumpor dioksid
| Sumpor-dioksid | |||
|---|---|---|---|

| |||
| |||
| Drugi nazivi | sumpor(IV)-oksid; anhidrid sumporaste kiseline | ||
| Identifikacija | |||
| CAS registarski broj | 7446-09-5 | ||
| PubChem[1][2] | 1119 | ||
| ChemSpider[3] | 1087 | ||
| UNII | 0UZA3422Q4 | ||
| EINECS broj | |||
| UN broj | 1079, 2037 | ||
| KEGG[4] | |||
| MeSH | |||
| ChEBI | 18422 | ||
| ChEMBL[5] | CHEMBL1235997 | ||
| RTECS registarski broj toksičnosti | WS4550000 | ||
| Bajlštajn | 3535237 | ||
| Gmelin Referenca | 1443 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | SO2 | ||
| Molarna masa | 64.054 g mol−1 | ||
| Agregatno stanje | bezbojan gas | ||
| Gustina | 2.551 g/L, gas | ||
| Tačka topljenja |
−72.4 °C (200.75 K) | ||
| Tačka ključanja |
−10 °C (263 K) | ||
| Rastvorljivost u vodi | 9.4 g/100 mL (25 °C)[6] | ||
| pKa | 1.81 | ||
| Struktura | |||
| Oblik molekula (orbitale i hibridizacija) | Iskrivljen pod uglom od 120° | ||
| Dipolni moment | 1.63 D | ||
| Opasnost | |||
| EU-klasifikacija | Otrovan | ||
| NFPA 704 | |||
| R-oznake | R23 R34 | ||
| S-oznake | (S1/2) S9 S26 S36/37/39 S45 | ||
| Tačka paljenja | nije zapaljiv | ||
| Srodna jedinjenja | |||
| Srodna jedinjenja | Sumpor-trioksid; Sumporasta kiselina | ||
|
| |||
| Infobox references | |||
Sumpor-dioksid (molekulska formula SO2) je bezbojni gas zagušljivog mirisa koji nastaje spaljivanjem sumpora na vazduhu. Teži je od vazduha. Rastvara se u vodi. Rastvor koji nastaje je kiseo jer gas reaguje sa vodom gradeći sumporastu kiselinu (H2SO3) čime se dokazuje da je sumpor-dioksid kiseli oksid. Sumporasta kiselina je nestabilna i lako se ponovo razlaže na sumpor-dioksid i na vodu.[7]
Rastvor sumpor-dioksida u vlažnoj okolini deluje kao izbeljivač tako što redukuje sastojke u materiji koja se izbeljuje.
Sumpor-dioksid je nusprodukt rada automobilskih motora i fabričkih postrojenja i zagađuje životnu sredinu. Napada sistem za disanje ljudi i životinja. Rastvarajući se u vazduhu uzrokuje kisele kiše koje uništavaju biljke, metalne konstrukcije i građevine.
Sumpor dioksid se dobija izgaranjem sumpora s kisikom iz zraka:
- S + O2 → SO2
ili prženjem sulfidnih ruda, obično pirita:
- 4FeS2 + 11O2 → 2Fe2O3 + 8SO2
Pri običnoj temperaturi sumpor dioksid je gas, ali se može lako ukapljiti, zbog postojanja dipola u strukturi molekule.
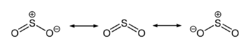
Sumpor dioksid ima neugodan miris i otrovan je za niže organizme, pa se upotrebljava za sterilizaciju suhog voća. U vinu služi kao antioksidans i antibiotik. Osim što sprječava njegovo kvarenje, služi i za održavanje odgovarajuće kiselosti. Sumpor dioksid ima redukciono djelovanje, jer može lahko preći u više oksidacijsko stanje. Ova osobina omogućava njegovo korištenje kao izbjeljivač. Sa vodom daje sulfitnu kiselinu, koja nije poznata u čistom stanju i postoji samo u vodenom rastvoru:
- SO2 + H2O → H2SO3
To je slaba kiselina i daje soli sulfite i hidrogensulfite. I sulfitna kiselina kao i sumpor dioksid ima redukciono djelovanje.
- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519.
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846.
- ↑ Joanne Wixon, Douglas Kell (2000). „Website Review: The Kyoto Encyclopedia of Genes and Genomes — KEGG”. Yeast 17 (1): 48–55. DOI:10.1002/(SICI)1097-0061(200004)17:1<48::AID-YEA2>3.0.CO;2-H.
- ↑ Gaulton A, Bellis LJ, Bento AP, Chambers J, Davies M, Hersey A, Light Y, McGlinchey S, Michalovich D, Al-Lazikani B, Overington JP. (2012). „ChEMBL: a large-scale bioactivity database for drug discovery”. Nucleic Acids Res 40 (Database issue): D1100-7. DOI:10.1093/nar/gkr777. PMID 21948594.
- ↑ Lide David R., ur. (2006). CRC Handbook of Chemistry and Physics (87th izd.). Boca Raton, FL: CRC Press. 0-8493-0487-3.
- ↑ Holleman A. F., Wiberg E. (2001). Inorganic Chemistry (1st edition izd.). San Diego: Academic Press. ISBN 0-12-352651-5.


