Citohrom c oksidaza

Enzim citohrom c oksidaza ili Kompleks IV (PDB 2OCC, EC 1.9.3.1) je veliki transmembranski proteinski kompleks nađen kod bakterija i mitohondrija.
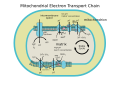
On je zadnji enzim u respiratornom lancu prenos elektrona mitohondrija (ili bakterija). On je lociran na membrani mitohondrija (ili bakterija). Ovaj enzim prima elektron od svakog od četiri citohrom c molekula, i prenosi iz na molekul kiseonika, konvertujući molekularni kiseonik u dva molekula vode. U tom procesu, on vezuje četiri protona iz unutrašnje vodene faze, i prenosi ih kroz membranu, čime pomaže uspostavljanju transmembranske razlike protonskog elektrohemijakog potencijala, koji ATP sintaza zatim koristi za ATP sintezu.

Kompleks velikog integralnog membranskog proteina koji se kod sisara sastoji od nekoliko metalnih prostetičkih mesta i 13 proteinskih podjedinica. Deset podjedinca potiču iz jedra, a tri su sintetisane u mitohondriji. Kompleks sadrži dve hem grupe, citohrom i citohrom a3, i dva bakarna centra, CuA i CuB[1]. Zapravo, citohrom a3 i CuB formiraju binuklearni centar koji je mesto redukcije kiseonika. Citohrom c, redukovan prethodnom komponentom respiratornog lanca (citohrom bc1 kompleks, kompleks III) se nalazi blizo CuA binuklearnog centera i prenosi elektron na njega, što dovodi do oksidacije citohroma c koji sadrži Fe3+. Redukovani CuA center zatim prenosi elektron na citohrom a, koji ga dalje prenosi na citohrom a3- CuB centar. Dva metalna jona ovog centra su na razmaku od 4.5 Å i oni koordiniraju hidroksilni jon u puno oksidovanom stanju.
Kritalografske studije citohrom c oksidaze su pokazale neobičnu postranskripcionu modifikaciju, kojom su vezani C6 iz Tyr(244) i ε-N iz His(240) (numerisano po goveđem enzimu). To ima vitalnu ulogu u osposobljavanju citohrom a3- CuB binuklearnog centra da prihvati četiri elektrona u procesu redukcije molekula kiseonika do vode. Za mehanizam redukcije se ranije smatralo do obuhvata peroksidnog posrednika, za koji se verovalo da dovodi do produkcije superoksida. Međutim, trenutno prihvaćeni mehanizam se sastoji od brze redukcije četiri elektrona direktnim otvaranjem kiseonik-kiseonik veze, bez intermedijara koji bi mogli da formiraju superoksid[2].
Smatra se da je mesto formiranja blizo TOM/TIM proteina, gde su intermedijari kompleksa dostupni da vežu podjedinice unesene iz citosola. Hem grupe i kofaktori se umeću u podjedinice. Neke od komponenti kompleksa IV mogu da formiraju intermedijarne pod-komplekse koji se kasnije vezuju za dodatne proteine i formiraju COX kompleks. Tokom daljih modifikacija nakon sklapanja, enzim se dimerizuje, što je neophodno za formiranje aktivnog/efikasnog enzima. Dimeri su spojeni molekulom kardiolipina.[3][4]
Sveukupna reakcija:
- 4 Fe2+-citohrom c + 8 H+in + O2 → 4 Fe3+-citohrom c + 2 H2O + 4 H+out
Dva elektrona se prenose sa dva citohroma c, kroz CuA i citohrom a mesta do citohrom a3- CuB binuklearnog centra, redukujući metale do Fe+2 i Cu+1. Hidroksidni ligand se protonuje i gubi vodu, stvarajući prazninu između metala koja se popunjava sa O2. Kiseonik se brzo redukuje, sa dva elektrona koja dolaze sa Fe+2 citohroma a3, koji se konvertuje u feril okso formu (Fe+4=O). Atom kiseonika blizo CuB preuzima jedan elektron od Cu+1, a drugi elektron i proton sa hidroksila sa Tyr(244), koji postaje tirozilni radikal: drugi kiseonik se konvertuje u hidroksidni jon preuzimanjem dva elektrona i protona. Treći elektron koji nastaje iz još jednog citohroma c prolazi kroz prva dva nosača elektrona do citohrom a3- CuB binuklearnog centra, i ovaj elektron i dva protona konvertuju tirozilni radikal nazad u Tyr, i hidroksil vezan za CuB+2 do molekula vode. Četvrti elektron iz još jednog citohroma c prolazi kroz CuA i citohrom a do citohrom a3- CuB binuklearnog centra, redukujući Fe+4=O u Fe+3, pritom atom kiseonika simultano preuzima proton, regenerišući ovaj kiseonik kao hidroksilni jon koordiniran u sredini citohrom a3- CuB centra, kao što je bio na početku ovog ciklusa. Net proces je da se četiri redukovana citohroma c koriste, zajedno sa 4 protona, da redukuju O2 do dva molekula vode.
Cijanid, sulfid, azid, i ugljen monoksid[5] se svi vezuju za citohrom c oksidazu, i kompetitivno inhibiraju protein, što dovodi do hemijske asfiksije ćelija. Metanol u metilisanim alkoholima se konvertuje u mravlju kiselinu koja takođe inhibira neke oksidazne sisteme.
Genetičke mutacije sa impaktom na funkcionalnost ili strukturu citohrom c oksidaze (COX) mogu da dovedu do ozbiljnih, često fatalnih metaboličkih poremećaja. Takvi poremećaji se obično manifestuju u ranom detinjstvu i predominantno utiču na tkiva sa visokim energijkim zahtevima (mozak, srce, mišići). Među mnogim klasifikovanim mitohondrijalnim poremećajima, oni koji su posledica ne funkcionalnog COX enzima su najozbiljniji.[6]
-
ETC
-
Kompleks IV
- Citohrom c oksidaza podjedinica I
- Citohrom c oksidaza podjedinica II
- Citohrom c oksidaza podjedinica III
- ↑ Tsukihara T., Aoyama H., Yamashita E., Tomizaki T., Yamaguchi H., Shinzawa-Itoh K., Nakashima R., Yaono R., Yoshikawa S. (1995). „Structures of Metal Sites of Oxidized Bovine Heart Cytochrome c Oxidase at 2.8 Å”. Science 269: 1069–1074. DOI:10.1126/science.7652554. PMID 7652554.
- ↑ Donald Voet, Judith G. Voet (2005). Biochemistry (3 izd.). Wiley. str. 818-820. ISBN 978-0-471-19350-0.
- ↑ Khalimonchuk, O.; Rödel, G. (2005). „Biogenesis of Cytochrome c Oxidase”. Mitochondrion 5 (6): 363–383. DOI:10.1016/j.mito.2005.08.002. PMID 16199211.
- ↑ Fontanesi, F.; Soto, I.; Horn, D.; Barrientos, A. (2006). „Assembly of mitochondrial cytochrome c-oxidase, a complicated and highly regulated cellular process”. Am. J. Physiol. Cell Physiol. 294 (6): C1129-C1147. DOI:10.1152/ajpcell.00233.2006. PMID 16760263.
- ↑ Alonso J, Cardellach F, López S, Casademont J, Miró O (2003). „Carbon Monoxide Specifically Inhibits Cytochrome C Oxidase of Human Mitochondrial Respiratory Chain”. Pharmacol. Toxicol. 93 (3): 142–6. DOI:10.1034/j.1600-0773.2003.930306.x. PMID 12969439.[mrtav link]
- ↑ Pecina, P.; Houstkova, H.; Hansikova, H.; Zeman, J.; Houstek, J. (2004). „Genetic Defects of Cytochrome c Oxidase Assembly”. Physiol. Res. 53 (Suppl. 1): S213-S223. PMID 15119951.
- Nicholas C. Price, Lewis Stevens (1999). Fundamentals of Enzymology: The Cell and Molecular Biology of Catalytic Proteins (Third izd.). USA: Oxford University Press. ISBN 019850229X.
- Eric J. Toone (2006). Advances in Enzymology and Related Areas of Molecular Biology, Protein Evolution (Volume 75 izd.). Wiley-Interscience. ISBN 0471205036.
- Branden C, Tooze J.. Introduction to Protein Structure. New York, NY: Garland Publishing. ISBN: 0-8153-2305-0.
- Irwin H. Segel. Enzyme Kinetics: Behavior and Analysis of Rapid Equilibrium and Steady-State Enzyme Systems (Book 44 izd.). Wiley Classics Library. ISBN 0471303097.
- Robert A. Copeland (2013). Evaluation of Enzyme Inhibitors in Drug Discovery: A Guide for Medicinal Chemists and Pharmacologists (2nd izd.). Wiley-Interscience. ISBN 111848813X.
- Gerhard Michal, Dietmar Schomburg (2012). Biochemical Pathways: An Atlas of Biochemistry and Molecular Biology (2nd izd.). Wiley. ISBN 0470146842.