Geometrija molekula
Molekularna geometrija ili molekularna struktura je tro-dimenziono(3D ) uređenje atoma koji sačinjavaju molekul. Ona uslovljava niz osobina supstance među kojima su reaktivnost, polarnost, faza materije, boja, magnetizam, i biološka aktivnost.[1][2]
Eksperimentalne metode[uredi | uredi kod]

Čak i najbolji elektronski mikroskopi nisu u stanju da pokažu izgled molekula već samo obrise i to samo ogromnih molekula kao što su proteini. Ipak postoje metode pomoću kojih se može odrediti tj. predvideti geometrija molekula samo uz pomoć strukturne formule. Najjednostavnija metoda za predviđanje prostornog oblika hemijskih jedinjenja jeste ona koja koristi pravilo o odbijanju valentnih elektronskih parova. Po ovoj metodi raspored elektronskih parova u najvišem elektronskom nivou oko centralnog atoma određuje prostorni oblik molekula. Elektroni su negativno naelektrisane čestice, što uzrokuje raspored u kome su oni najudaljeniji jedan od drugog. Kad rastojanje bude najveće, odbijanje će biti najmanje, te će molekul biti najstabilniji. Raspored valentnih elektronskih parova zavisi od njihovog broja. Npr. kod metana (CH4) četri elektronska para najmanje će se odbijati ako se nalaze na ivicama pravilnog tetraedra.
Kod jedinjenja sa 3 elektronska para (npr. BF3) molekul je najstabilniji kada se parovi nalaze pod uglovima od 120°; raspored je u jednoj ravni. Ako je centralni atom okružen velikim brojem valentnih elektronskih parova molekul može da ima veoma različite oblike. Razmatranje prostornog rasporeda atoma u molekulu je veoma kompleksan deo hemije i njime se bavi zasebna disciplina - stereohemija. Dinamička stereohemija podatke dobijene o prostornom rasporedu koristi za predviđanje ponašanja tih molekula u hemijskim reakcijama, što je od posebnog značaja za organske reakcije u organzmu koje su veoma stereospecifične.
Molekularna geometrija može biti određena raznim spektroskopskim i difrakcionim metodima. IR, mikrotalasna i Ramanova spektroskopija mogu da proizvedu informacije o molekulskoj geometriji iz detalja detektovanih vibracionih i rotacionih apsorbanci. Kristalografija, neutronska difrakcija i elektronska difrakcija mogu da proizvedu molekularnu strukturu kristala na bazi rastojanja između jezgra i koncentracije elektronske gustine. Gasna elektronska difrakcija se može koristiti za male molekule u gasnoj fazi. NMR i FRET metodi se mogu koristiti za određivanje komplementarnih informacija kao što su relativna rastojanja,[3][4][5] diedralni uglovi,[6][7] uglovi veza, i povezanost. Niže temperature su podesnije za određivanje molekularne geometrije, jer su višim temperaturama one srednje vrednosti dostupnih geometrija. Veći molekuli se često javljaju u više stabilnih geometrija (konformacioni izomerizam) sa sličnim energetskim nivoima na površini potencijalne energije. Geometrije se isto tako mogu izračunati koristeći ab initio kvantum hemijski metode do visoke preciznosti. Molekularna geometrija može da se bude različita u čvrstoj, tečnoj, i gasovitoj fazi.
Izomeri[uredi | uredi kod]
Izomeri su tipovi molekula koji imaju istu hemijsku strukturu ali različite geometrije, posledica čega su veoma različite osobine:
- Čista supstanca se sastoji od samo jednog tipa izomera.
- Strukturni izomeri imaju istu hemijsku formulu ali različite fizičke aranžmane, često formirajući alternativne molekularne geometrije sa veoma različitim osobinama. Atomi nisu vezani u istom redu.
- Funkcionalni izomeri su specijalna vrsta strukturnih izomera, gde pojedine grupe atoma ispoljavaju specijalne načine ponašanja, kao što su etar ili alkohol.
- Stereoizomeri mogu da imaju mnoge slične fizičko-hemijske osobine (tačka topljenja, tačka ključanja) i istovremeno veoma različite biohemijske aktivnosti. To je zbog toga što oni manifestuju hiralnost koja se često sreće kod živih sistema. Jedna manifestacija hiralnosti je njihova sposobnost rotiranja polarizovane svetlosti u različitim smerovima.
- Proteinsko sklapanje je proces formiranja molekula kompleksne geometrije i različitih izomera koje proteini mogu da imaju.
Tipovi molekulske strukture[uredi | uredi kod]
Postoji šest osnovnih tipova molekula
- Linearni: U linearnom modelu, atomi su vezan u pravoj liniji. Uglovi veza su 180°. Primer takvog molekula je ugljen dioksid.
- Trigonalno planarni: Ovi molekul su trougaoni i leže u jednoj ravni. NJihovi uglovi veza su 120°. Primer molekula iz ove grupe je bor trifluorid.
- Tetraedralni: Ovi molekuli imaju četiri površine. Oni imaju četiri veze na centralnom atomu bez dodatnih slobodnih elektronskih parova. Uglovi veza između elektronskih veza su arccos(−1/3) = 109.47°. Primer tetraedralnog molekula je metan (CH4).
- Oktaedralni: Oni imaju osam površina. Ugao veza je 90 stepeni. Primer oktaedralnog molekula je sumpor heksafluorid (SF6).
- Piramidalni: Ovi molekuli imaju piramidni oblik. Oni imaju tri para vezanih elektrona, i slobodni elektronski par. Odbijanje slobodnog para i vezanih parova menja ugao od tetraedralnog do nešto manje vrednosti. Primer je NH3 (amonijak).
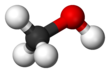
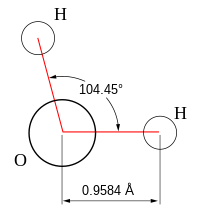
- Povijeni: Povijeni ili ugaoni molekuli imaju nelinearni oblik. Primer takvog molekula je voda, ili H2O, koja ima ugao veza od oko 106o Molekul vode ima dva para vezanih elektrona i dva slobodna para.
VSEPR tabela[uredi | uredi kod]
Uglovi veza u sledećoj tabeli su idealni uglovi iz jednostavne VSEPR teorije. NJima slede stvarni uglovi za date primere, ukoliko se oni razlikuju. U mnogim slučajevima, kao što je trigonalni piramidalni i povijeni, stvarni ugao primera se razlikuje od idealnog ugla. Ugao u H2S (92°) se razlikuje od tetraedralnog ugla mnogo više, nego što je to slučaj za H2O (104.5°) ugao.
| Vezujućih elektronskih parova | Slobodnih parova | Elektronski domeni (Sterni #) | Oblik | Idealni ugao veze (ugao veze primera) | Primer | Slika |
|---|---|---|---|---|---|---|
| linearni | ||||||
| trigonalno planarni | ||||||
| povijeni | ||||||
| tetraedralni | 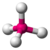 | |||||
| trigonalno piramidalni | ||||||
| ugaoni | ||||||
| trigonalno bipiramidalni |  | |||||
| testerasti | ||||||
| T-oblik | ||||||
| linearni | ||||||
| oktaedralni | 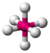 | |||||
| kvadratno piramidalni | ||||||
| kvadratno planarni | ||||||
| pentagonalno bipiramidalni |  |
3D Reprezentacije[uredi | uredi kod]
- Linija ili štap - atomska jezgra nisu predstavljena. Kao i kod 2D molekularnih struktura ovog tipa, atomi se podrazumevaju na temenima.
- Grafik elektronske gustine - prikazuje elektronsku gustinu određenu bilo kristalografski ili koristeći kvantnu mehaniku
- Kugla i štap - atomska jezgra su predstavljena kao sfere (kugle) i veze kao štapovi
- Prostor-popunjavajući modeli ili CPK modeli - molekul je prikazan preklapajućim sferama koje predstavljaju atome
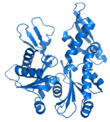
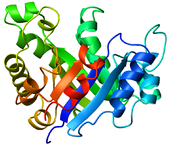
- Dijagram - prikaz proteina gde se petlje, beta ravni, i alfa heliksi prikazuju dijagramom. Atomi ili veze nisu eksplicitno prikazani, već samo proteinska osnova kao glatka cev.
Reference[uredi | uredi kod]
- ↑ McMurry John E. (1992). Fundamentals of Organic Chemistry (3rd izd.). Belmont: Wadsworth. ISBN 0-534-16218-5.
- ↑ Clayden Jonathan, Nick Greeves, Stuart Warren, Peter Wothers (2001). Organic chemistry. Oxford, Oxfordshire: Oxford University Press. ISBN 0-19-850346-6.
- ↑ „FRET description”. Arhivirano iz originala na datum 2008-09-18. Pristupljeno 2014-03-19.
- ↑ Hillisch, A; Lorenz, M; Diekmann, S (2001). „Recent advances in FRET: distance determination in protein–DNA complexes”. Current Opinion in Structural Biology 11 (2): 201-207. DOI:10.1016/S0959-440X(00)00190-1. PMID 11297928.
- ↑ „FRET imaging introduction”. Arhivirano iz originala na datum 2008-10-14. Pristupljeno 2014-03-19.
- ↑ obtaining dihedral angles from 3J coupling constants
- ↑ „Another Javascript-like NMR coupling constant to dihedral”. Arhivirano iz originala na datum 2005-12-28. Pristupljeno 2014-03-19.
Literatura[uredi | uredi kod]
- Ernest L. Eliel, Samuel H. Wilen (1994). Stereochemistry of Organic Compounds (1 izd.). Wiley, John & Sons, Incorporated. ISBN 978-0-471-01670-0.
- Ernest L. Eliel, Samuel H. Wilen, Michael P. Doyle (2001). Basic Organic Stereochemistry. Wiley-Interscience. ISBN 978-0-471-37499-2.
- Kurt Martin Mislow Kurt Mislow (Jan 15, 2003). Introduction to Stereochemistry. Dover Publications. ISBN 978-0-486-42530-6.
- D. Nasipuri (1994). Stereochemistry of Organic Compounds: Principles and Applications (2 edition izd.). South Asia Books. ISBN 978-81-224-0570-5.