Oksoanjon
Oksoanjon (oksianjon, oksianion, oksoanion) je ion sa generičkom formulom AxOyz− (gdje A predstavlja hemijski element a O atom kisika). Oksoanioni se velikom većinom formiraju od hemijskih elemenata. Formule jednostavnih oksoaniona utvrđuje se prema oktetnom pravilu. Strukture kondenziranih oksoanions mogu se racionalizirati u smislu AOn poliedarskih jedinice sa zajedničkim uglovima ili ivicama između poliedara. Fosfatni i polifosfatni estri – adenozinski monofosfat ( AMP), adenozinski difosfat ( ADP) i adenozinski trifosfat (ATP) su posebno značajni u biološkim procesima otpuštanja/skladištenja energije.
Monomerni oksoanioni[uredi | uredi kod]
Formula monomernih oksoaniona, AOnm−, diktira oksidacijsko stanje elementa i njegovu poziciju u periodnom sistemu. Elementi prvog reda su ograničeni na maksimalan koordinacijski broj 4. Međutim, ni jedan od prvih elemenata reda nema monomernih oksoaniona sa tim brojem koordinacijskim brojem. Umjesto toga, karbonat (CO2−
3) i nitrat (NO3−) imaju trouglastuu planarnu struckturu sa π vazom između centralnog i kisikovih atoma. Ovo π vezanje favorizirano je od sličnošću u veličini centralnog atoma i kisika.
Oksoanioni drugog reda elemenata u grupa oksidacijskog stanja su tetraedralni. Tetraedarske jedinice SiO4 nalaze se u olivinskim mineralima [Mg, Fe] SiO4, ali aniona nema odvojenih kao što su atomi kisika okružene tetraedarskim kationima u čvrstom stanju. Fosfat (PO43–), sulfat (SO42–) i perhlorat (ClO4x–) ioni mogu se naći kao takvi u raznim solima. Mnogi oksoanioni elemenata u donjem oksidacijskom stanju poštuju pravilo okteta, što se može koristiti za racionalizaciju usvojene formule. Naprimjer, hlor (V) ima dvovalentne elektrone, tako da može primiti tri elektronska para iz veze s ionom oksida. Naboj ovog iona je +5 − 3 × 2 = −1, tako da mu je formula ClO3–. Struktura iona predviđena je u teoriji VSEPR kao piramidna, sa tri vezana elektronska para i jednim usamljenim parom. Na sličan način, oksianion hlora (III) ima formulu ClO2– i vezani sa dva slobodna para i dva vezana para.
| Oksidacijsko stanje | Ime | Formula | Slika |
|---|---|---|---|
| +1 | Hipohloritni ion | ClO− | 
|
| +3 | Hloritni ion | ClO2− | 
|
| +5 | Hloratni ion | ClO3− | 
|
| +7 | Perhloratni ion | ClO4− | 
|
U trećem i narednim redovima periodnog sistema, moguća je 6-koordinacija, ali izolirani oktaedarni oksoanion nisu poznati jer bi imali previsok električni naboj. Tako molibden (VI) ne formira MoO6−
6, ali obrazuje tetraedarski molibdatni anion, MoO2−
4. Jedinice MoO6 nalaze se u kondenzovanim molibdatima. U takvim vrstama nalaze se potpuno protonovani oksoanioni sa oktaedarskom strukturom u Sn(OH)2−
6 i Sb(OH)6−.
Imenovanje[uredi | uredi kod]
Imenovanje monomernih oksoaniona slijedi naredna pravila.
- Ako centralni atom nije u groupi VII
| Oksidacijski broj centralnog atoma | Shema imenovanja | Primjeri |
|---|---|---|
| = Grupni broj | *−at | Borat (BO3− 3), Karbonat (CO2− 3), Nitrat (NO3−), Fosfat (PO3− 4), Sulfat (SO2− 4), Hromat (CrO2− 4), Arsenat (AsO3− 4) |
| = Grupni broj − 2 | *−it | Nitrit (NO2−), Fosfit (PO3− 3), Sulfit (SO2− 3), Arsenit (AsO3− 3) |
| = Grupni broj − 4 | hipo−*−it | Hipofosfit (PO3− 2), Hiposulfit (SO2− 2) |
- Ako je centralni atom u grupi VII
| Oksidacijski broj centralnog atoma | Shema imenovanja | Primjeri |
|---|---|---|
| = Grupni broj | per−*−at | Perhlorat (ClO4−), Perbromat (BrO4−), Perjodat (IO4−), Permanganat (MnO4−) |
| = Grupni broj − 2 | *−at | Hlorat (ClO3−), Bromat (BrO3−), Jodat (IO3−) |
| = Grupni broj − 4 | *−it | [Hlorit]] (ClO2−), Bromit (BrO2−) |
| = Grupni broj − 6 | hipo−*−it | Hipohlorit (ClO−), Hipobromit (BrO−) |
Kondenzacijske reakcije[uredi | uredi kod]
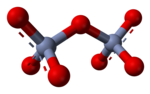
U vodenoj otopini, oksoanioni sa visokim nabojem mogu proći kondenzacijskee reakcije, kao u formiranju dihromatnog iona (Cr2O2−
7):
- 2 CrO2−
4 + 2 H+ ⇌ Cr2O2−
7 + H2O
Sila za ovu reakciju je smanjenje električne gustoće naboja na anionu i eliminacija H+ ion. Iznos reda u otopini se smanjuje, oslobađajući određenu količinu entropije što čini Gibbsovu slobodnu energiju negativnijom i favorizuje narednu reakciju. To je primjer acido-bazne reakcije sa monomernim oksoanionom koji djeluje kao baza i kondenzirani oksoanioni djelujući kao njegova konjugirana kiselina. Obrnuta reakcija je hidroliza, kao u molekuli vode, djelujući kao baza, gdje dolazi do diobe. Može doći i do dalje kondenzacije, posebno kod aniona većeg nabojan, kao što se dešava sa adenozin-fosfatima.
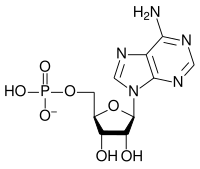
|

|
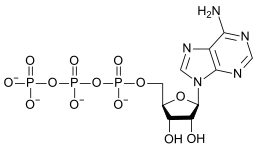
|
| AMP | ADP | ATP |
Pretvaranje ATP u ADP je hidrolizna reakcija koja je značajan izvor energije u biološkim sistemima. Formiranja većine silikatnih mineralajavlja se kao rezultat reakcije dekondenzacije gdje silicij reagira sa baznim oksidom, u kiseloinski-baznoj reakciji.
- CaO (base) + SiO2 (acid) → CaSiO3
Strukture i formule polioksoaniona[uredi | uredi kod]


Kao polioksoanion je polimerni oksoanion sa više oksoanionskih monomera, koji se obično smatra MOnpoliedrom, sa zajedničkim uglovima i rubovima.[1] Kada su zajednička dva ugla poliedra rezultirajuća struktura može biti lanac ili prsten. Kratki lanci javljaju s, naprimjer, u polifosfatima. Inosilikati, kao što su pirokseni, imaju dugi lanac tetraedra SiO4 sa svim zajedničkim uglovima. Ista struktura se javlja i kod tzv. meta-vanadata, kao što je amonij-metavanadat, NH4VO3.
Formula oksoaniona, SiO2−
3 dobija se kako slijedi: svaki nominalni silicijev ion (Si4+) veže se sa dva nominala oksidna iona (O2−) i imaju polovinu zajedničkih sa ostalima. Takva stehiometrija i električni naboj dati su izrazom:
- Stehiometrija: Si + 2 O + (2 × 1⁄2) O = SiO3
- Naboj: +4 + (2 × −2) + (2 × (1⁄2 × −2)) = −2.
Prsten se može posmatrati kao lanac u kojem su se dva kraja spojila. Primjer je ciklički trifosfat P3O3−
9.
Kada su zajednička tri ugla, struktura se proteže u dvije dimenzije. U amfibolima (od kojih je primjer azbest), dva lanca su povezana zajedno dijelewći treći ugao na alternativnim mjestima duž lanca. To rezultira u idealnoj formuli Si4O6−
11 i linearnoj strukturi lanca, što objašnjava vlaknastu prirodu tih minerala. Prisustvo tri zajednička ugla može dovesti do strukture lista, kao u [|liskun]]u, Si2O2−
5, u kojem svaki silicij ima jedan kisik za sebe i pa pola dijele sa tri druga. Kristalni liskun može se cijepati u vrlo tanke listove.
Postojanje sva četiri zajednička ugla rezultata tetraedrom u 3-dimenzijskoj strukturi, kao što je u kvarcu. Aluminosilikati su minerali u kojima se neki silicij zamijenjen aluminijem. Međutim, oksidacijsko stanje aluminija je jedno manje od silicija, tako da zamjena mora biti praćen dodavanjem drugog kationa. Broj mogućih kombinacija takve strukture je vrlo veliki, što je, u dijelu, razlog zašto postoji toliko aluminosilikata.
28
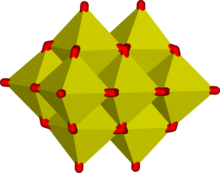
Oktoedarske jedinice MO6 su uobičajene u oksoanionima metala tranzicije. Neki spojevi, kao što su soli lančanih polimernih iona, Mo2O2−
7. Čak sadrže i tetraedarne i oktaedarne jedinice.[2][3]
Zajednički rubovi uobičajeni su u ionima koji sadrže oktaedarske blokove i oktaedrima koji su obično iskrivljeni da se smanji naprezanje za premošćavanje atoma kisika. To rezultira u 3-dimenzijskoj strukturi zvanoj polioksometalati. Tipski primjeri su Kegginova struktura fosfomolibdatskog iona. Zajednička ivica je efikasno sredstvo za smanjenje električne gustoće naboja, kao što se vidi u hipotetskoj reakciji kondenzacije koja uključuje dva oktaedra:
- 2 MO6n− + 4 H+ → Mo2O10(n−4)− + 2 H2O
Ovdje je prosječni naboj svakog atoma (M) smanjen 2 puta. Efikasnost zajedničkog ruba ogleda se u sljedećim reakcijama, što se dešavaju kada se alkalni vodeni rastvor molibdata zakiseli.
- 7 MoO2−
4 + 8 H+ ⇌ Mo7O6−
24 + 4 H2O
Tetraedrni ion molibdata je pretvoren u klaster sedam rubova povezanih oktaedrom.[4] dajući prosječni naboj svakom atomu molibdena od 6⁄7. Heptamolibdatski klaster je tako stabilan sa klasteri između 2 i 6 molibdatskih jedinica ne mogu se otkriti čak i kada se moraju formirati kao međuproizvodi.
Heuristika za kiselost[uredi | uredi kod]
Utvrđeno je da pKa srodnih kiselina može pogoditi iz broja dvostrukih veza sa kisikom. Tako je perhlorna kiselina vrlo jaka kiselina, dok je hipohlorna vrlo slaba. Jednostavno pravilo obično vrijedi od oko 1 pH jedinice.
Kiselinsko–bazna svojstva[uredi | uredi kod]
Većina oksoaniona su slabe baze i mogu se protonirati da daju kiseline ili soli kiselina. Naprimjer, fosfatni ion može se sukcesivno protonirati da formira fosfornu kiselinu.
- PO3−
4 + 3 H+ ⇌ HPO2−
4 + 2 H+ ⇌ H2PO4− + H+ ⇌ H3PO4

3

.
Proširena protonacija u vodenoj otopini će zavisiti od kiselinska konstanta disocijacije i pH. Naprimjer, AMP (adenozin-monofosfat) ima pKa vvrijednost 6,21,[5] tako da će na pH 7 biti protoniziran oko 10%. U ovim reakcijama protonacije, značajan faktor jer neutralizacija naboja. Nasuprot tome, univalentni anioni perhlorata i permanganata su vrlo teški za protoniranje, što odgovara jakim kiselinama. Iako kiseline kao što je fosforna napisane kao H3PO4, protoni su vezani za atome kisika, formirajući hidroksilne grupe, tako da se formula također može pisati kao OP(OH)3 što bolje odražava njenu strukturu. Sumporna kiselina može se pisati kao O2S(OH)2; ovakve molekule se javljaju u plinskoj fazi.
Fosfitni ion, PO3−
3, je jaka baza, pa tako uvijek nosi najmanje jedan proton. U ovom slučaju proton je prikačen direktno na atom fosfora sa strukturom HPO2−
3. U formiranju ovog iona, fosfitni ion se ponaša kao Lewisova baza i označava par electrona na Lewisovoj kiselini, H+.

Kao što je gore pomenuto, reakcija kondenzacije je i kiselo-bazna reakcija. U mnogim sistemima, može doći i do protonacijske i kondenzacijske reakcije. Slučaj hromatnog iona pruža relativno jednostavan primjer. Dijagram predominacije za hromat, prikazan na desnoj strani, pCr lanac za negativni logaritam koncentracije hroma i pH označava negativan logaritam H+ koncentracije iona. Postoje dvije nezavisne ravnoteže. Konstanta ravnoteže definirana je kako slijedi:[6]
CrO2−
4 + H+ ⇌ HCrO4−log K1 = 5.89 2 HCrO4− ⇌ Cr2O2−
7 + H2Olog K2 = 2.05
Dijagrampredominacije se interpretira, kako slijedi
- Hromatni ion, CrO2−
4, je predominantna vrsta pri visokom pH. Kako pH rarte, ion hromata postaje sve predominantniji, sve dok ne postane jedini oblik u rastvoru sa pH > 6,75. - Na pH < pK1vodik-hromatni ion, HCrO4− je predominantan u razblaženom rastvoru.
- Dihromatni ion, Cr2O2−
7, je predominantan u koncentriranijim rastvorima, izuzev pri visokom pH.
Vrsta H2CrO4 i HCr2O7− nisu prikazani jer se formiraju samo po vrlo niskim pH.
Dijagram predominacije može postati veoma kompliciran, kada se mogu formirati mnogi polimerni oblici,[7] kao kod vanadata, molibdata, volframata. Druge komplikacije mogu se javiti kada se mnogi od viših polimera formiraju izuzetno sporo, tako da se ravnoteža se može postići ni u mjesecima, što dovodi do eventualne greške u konstanti ravnoteže i dijagramu predominacije.
Povezano[uredi | uredi kod]
Reference[uredi | uredi kod]
- ↑ Mueller, U. (1993). Inorganic Structural Chemistry. Wiley. ISBN 0-471-93717-7.
- ↑ Lindqvist, I.; Hassel, O.; Webb, M.; Rottenberg, Max (1950). „Crystal Structure Studies on Anhydrous Sodium Molybdates and Tungstates”. Acta Chem. Scand. 4: 1066–1074. DOI:10.3891/acta.chem.scand.04-1066.
- ↑ Wells, A.F. (1962). Structural Inorganic Chemistry (3rd izd.). Oxford: Clarendon Press. str. 446.
- ↑ Lindqvist, I., Arkiv. Kemi, 2, 325 (1950)
- ↑ da Costa, C.P.; Sigel, H. (2000). „Lead(II)-Binding Properties of the 5′-Monophosphates of Adenosine (AMP2−), Inosine (IMP2−), and Guanosine (GMP2−) in Aqueous Solution. Evidence for Nucleobase−Lead(II) Interactions”. Inorg. Chem. 39 (26): 5985–5993. DOI:10.1021/ic0007207. PMID 11151499.
- ↑ Brito, F.; Ascanioa, J.; Mateoa, S.; Hernándeza, C.; Araujoa, L.; Gili, P.; Martín-Zarzab, P.; Domínguez, S. i dr.. (1997). „Equilibria of chromate(VI) species in acid medium and ab initio studies of these species”. Polyhedron 16 (21): 3835–3846. DOI:10.1016/S0277-5387(97)00128-9.
- ↑ Pope, M.T. (1983). Heteropoly and Isopoly Oxometalates. Springer. ISBN 0-387-11889-6.
![{\displaystyle K_{1}={\frac {[\mathrm {HCrO_{4}^{-}} ]}{[\mathrm {CrO_{4}^{2+}} ][\mathrm {H^{+}} ]}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/ba5183a196a004435f83e9cce025b6260ee6b4ed)
![{\displaystyle K_{2}={\frac {[\mathrm {Cr_{2}O_{7}^{2-}} ]}{[\mathrm {HCrO_{4}^{-}} ]^{2}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/8247e0ecc828c99522eb74cce96893d4a0ca1f60)
