Getit
| Getit | |
|---|---|
 Getit iz brazilske pokrajine Minas Gerais |
|
| Općenito | |
| Kategorija | Metalni oksid |
| Kemijska formula | α-FeOOH |
| Identifikacija | |
| Molekularna masa | 88.86 g/mol |
| Boja | Žuta do tamno smeđa ili crna |
| Kristalni habitus | izdužen |
| Kristalni sustav | Rompski, Pbnm |
| Kalavost | [010] |
| Mohsova tvrdoća | 5-5,5 |
| Ogreb | smeđ do žut |
| Gustoća | 4,26 g/cm3 |
Getit, željezov oksihidroksidni mineral, kemijska formula α-FeOOH, nazvan po velikom njemačkom književniku Johannu Wolfgangu von Goetheu. Stabilan je pri umjerenim temperaturama i zbog toga vrlo rasprostranjen u prirodi. Najstabilniji je i najrasprostranjeniji željezov oksihidroksid.
Ljudi su upotrebljavali getit još u prethistorijsko doba o čemu svjedoče nalazi boje sa zidnih crteža u spiljama Lascaux u Francuskoj. Prvi je put opisan godine 1806. na temelju uzoraka iz rudnog područja Mesabi u Minnesoti, Sjedinjene Države.
Getit obično nastaje starenjem drugih željezom bogatih minerala i zbog toga je uobičajen sastavni dio tla. Također može nastati taloženjem u podzemnim vodama ili u drugim sedimentarnim uvjetima, a može nastati i kao primarni mineral u hidrotermalnim nanosima.
Tvrdoća getita kreće se od 5 do 5,5 na Mohsovoj skali, a specifična težina varira od 3,3 do 4,3, ovisno o uzorku. Getit obično tvori prizmatske igličaste kristale koji su obično grupirani u masivne agregate. Magnetsko uređenje getita dobre kristalnosti na sobnoj temperaturi je antiferomagnetsko s Néeelovom temperaturom od 400 K.[1].
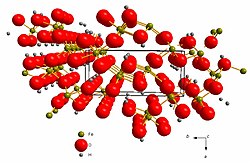
Struktura getita temelji se na heksagonskoj gustoj slagalini kisikovih aniona (O2-) između kojih su u oktaedrijske šupljine smješteni kationi željeza (Fe3+). Kationi željeza okruženi su sa po 6 kisikovih aniona od kojih 3 imaju vezan vodikov atom (hidroksilni anioni, OH-).
Kristalna struktura getita pripada rompskom kristalografskom sustavu i prostornoj grupi Pbnm s parametrima jedinične ćelije a = 4.587 Å, b = 9.937 Å i c = 3.015 Å .[2] Jediničana ćelija sadrži 4 formulske jedinke.



Ovisna je o veličini kristalnih zrna. U masivnim kristalnim agregatima, getit je tamno smeđ ili crn, dok je u praškastom obliku svijetlo smeđ ili žut. Zbog velike moći bojanja, kemijske stabilnosti i neotrovnosti vrlo je velika uporaba getita kao pigmenta.
Polazni materijal za sintezu su gotovo uvijek željezove(II) soli koje su jeftinije od željezovih(III) soli. Postupak se temelji na taloženju topljive željezove(II) soli s lužinom nakon čega slijedi oksidacija. Često korišten proces je tzv. Pennimanov proces u kojem se koriste željezov(II) sulfat, metalno željezo i natrijev hidroksid. Prvi korak u postupku je nastajanje klica u posebnom reaktoru pri temperaturi od 20 do 50 °C:
4FeSO4 + 8NaOH + O2 → 4α-FeOOH + 4Na2SO4 + H2O
Tako dobiven getit može se koristiti kao prozirni pigment, a ako se želi povećati moć prekrivanja čestice moraju dalje rasti u drugom reaktoru pri temperaturi od 75 do 90 °C:
4FeSO4 + 6H2O + O2 → 4α-FeOOH + 4H2SO4
4H2SO4 + Fe → FeSO4 + H2
Nastala sulfatna kiselina reagira s metalnim željezom čime se nadoknađuju ioni Fe2+. Prednost ovog procesa je to što je potrebna samo mala količina željezovog(II) sulfata i lužine da bi se inicirala reakcija. Variranjem vremena reakcije mogu se dobiti željene karakteristike pigmenta.
Osim postupka oksidacije otopine željezove(II) soli, α-FeOOH se u laboratoiju često sintetizira dodatkom lužine u otopinu neke željezove(III) soli:
FeCl3 + 3NaOH → α-FeOOH + 3 NaCl + H2O
Prisutnost getita u prirodnom ili sintetičkom uzorku može se dokazati pomoću niz instrumentalnih tehnika od kojih se mogu izdvojiti rentgenska difrakcija u prahu (XRD), Mössbauerova spektroskopija i infracrvena spektroskopija.
1. R. M. Cornell, U. Schwertmann, The Iron Oxides, Structure, Properties, Reactions, Occurrence and Uses, VCH Publ. Corp., D-69451 Weinheim, Njemačka, 1996.
2. C.F. Sampson, The Lattice Parameters of Natural Single Crystal and Synthetically Produced Goethite (α-FeOOH), Acta Cryst. B25 (1969) 1683.
