Cervikalna intraepitelna neoplazija
| Cervikalna intraepitelna neoplazija | |
|---|---|
 | |
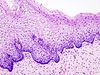
| Prikaz cervikalne neopazije u stadijumu CIN 1 | |
| Specijalnost | Ginekologija |
| Klasifikacija i eksterni resursi | |
| ICD-10 | D06, N87 |
| ICD-9 | 233.1, 622.10 |
| MedlinePlus | 001491 |
| MeSH | D018290 |
Cervikalna intraepitelna neoplazija (CIN), cervikalna displazija, cervikalna intersticijalna neoplazija je preinvazivna promena na grliću materice za koju se danas zna da, iako se ne leči, u većini slučajeva se spontano povlači. Međutim ova promene se tokom određenog vremena u ovoj promeni se može razviti u invazivni karcinom ili rak grlića materice.[1][2]
Anatomija[uredi | uredi kod]
Vrat materice (lat. cervix uteri) je njen donji, cilindrični deo koji se nastavlja na trup materice (lat. corpus uteri). Spoljna strana cerviksa (lat. exocervix), koja štrči u lumen vagine, kao i sama materica obložena je višeslojnim pločastim epitelom, dok je unutrašnja strana cerviksa (lat. endocervix) obložena jednoslojnim cilindričnim epitelom.[3]
Mesto, u kojem višeslojni pločasti epitel egzocerviksa prelazi u jednoslojni cilindrični epitel endocerviksa, nosi naziva skvamokolumnarna granica (SKG). U zavisnosti od trenutnog hormonskog statusa i životne dobi, položaj skvamokolumnarne granice se menja.[1] U hormonski neaktivnim periodima (detinjstvo i postmenopauza) SKG nalazi se dublje u cervikalnom kanalu, dok je u hormonski aktivnim periodima (novorođenački period života, pubertet, generativni period života, trudnoća i kod žena koje uzimaju oralne hormonske kontraceptive) SKG pomerena niže, van cervikalnog kanala.[1] Kada je skvamokolumnarna granica pomerena niže, jednoslojni cilindrični epitel koji je osetljiviji, na uticaj niskog pH u vagini zamenjuje se otpornijim, metaplastične pločastim epitelom. Zato se na egzocerviksu mogu uočiti dve skvamokolumnarne granice i zona preobražaja:
- Prva koja je originalna ili primarna SKG u kojoj jednoslojni cilindrični epitel prelazi u originalni višeslojni pločasti epitel pre procesa metaplazije,
- Druga ili sekundarna SKG koja je aktivna, i u kojoj jednoslojni cilindrični epitel prelazi u metaplazijom promenjeni pločasti epitel.
- Zona preobražaja je područje između primarne i sekundarne skvamokolumnarna granice (ili transformatciona zona)).
Kako je nezreli metaplastične pločasti epitel osetljiv na delovanje raznih onkogenih faktora cervikalna intraepitelna neoplazija (CIN) u najvećem broju slučajeva počinje kao žarište u zoni preobražaja.

Etiologija[uredi | uredi kod]
Cervikalna intraepitelna neoplazija je primarna bolest polno aktivnih žena, a zboga faktora rizika, smatra se i polno prenosivom bolešću, za čiji razvoj najznačajniju ulogu ima humani papiloma virus (HPV).
Faktori rizika[uredi | uredi kod]
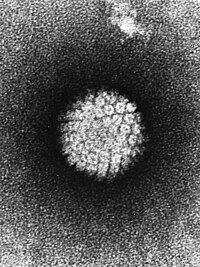
Kao mogući faktori rizika povezani sa razvojem cervikalne intraepitelne neoplazije navode se:
- Rani početak polne aktivnosti,
- Češće menjanje polnih partnera,
- Infekcija humanim papiloma virusom (HPV) visokog rizika,
- Polno prenosive bolesti (npr herpes, hlamidije),
- Brojne trudnoće i veći broj porođaja,
- Upotreba oralnih kontraceptiva,
- Pušenje cigareta.[4]
Iako se većina polno aktivnih žena barem jednom tokom života zarazi HPV-om, ta infekcija obično nije trajna i u većine žena dolazi do spontanog nestajanja virusa bez razvoja bolesti.[5][6] Međutim u manje od 10% žena koje se zaraze HPV-om, razviće se trajna infekcija koja može progredirati u teže oblike cervikalne intraepitelne neoplazije.[7][8] Do sada je otkriveno više od 200 podtipova HPV koji se u više od 95% slučajeva manifestuje kao preinvazivnih i invazivnih karcinoma cerviksa [7][9] Humani papiloma virus grupiše se u HPV visokog i niskog rizika, u zavisnosti od njihovog onkogena potencijala.
- HPV visokog onkogenog rizika
U ovu grupu HPV spadaju: 16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59, 66, i 68. Oni mogu uzrokovati intraepitelne promene visokog stepena ili karcinom cerviksa. HPV tip 16 i 18 su najčešće izolovani HPV tipovi, koji uzrokuju više od 71% invazivnih karcinoma. Međutim HPV tip 16 nije specifičan jer se može naći i u žena sa CIN I i te kod žena sa urednim Papanikolu testom.[7]
- HPV niskog onkogenog rizika
U ovu grupu HPV spadaju: 6, 11, 41, 42, 43 i 44. Oni su najčešće povezani sa benignim promenama kao što su kondilomi koji retko maligno alterira.[7].[10][11]
Makroskopske promene u cervikalnoj intraepitelnoj neoplaziji[uredi | uredi kod]
Makroskopski, promene u cervikalnoj intraepitelnoj neoplaziji (CIN) su nespecifične i mogu se manifestovati kao leukoplakija, erozija cerviksa, cervicitis ili nema nikakvih primetnih promena. Histološki se unutar epitela nalaze atipične ćelije sa hiperhromazijom jezgara i mitoze u površinskim slojevima epitela, ali bez znakova invazije u stromu.[12]
Brojnim istraživanjima potvrđeno da je cervikalna intraepitelna neoplazije prekanceroza i da u određenom procentu žena on prelazi u invazivni karcinom. Glavna razlika između karcinoma in situ i invazivnog karcinoma je ta što je kod karcinoma in situ tanka bazalna membrana, koja deli epitel od subepitelnog vezivnog tkiva u kojem se nalaze krvni i limfni sudove, još uvek intaktna, dok kod invazivnog karcinoma dolazi do prodora malignih ćelija kroz bazalnu membranu.[13][14]
Dijagnoza[uredi | uredi kod]
Osnovni kriterijum za dijagnozu intraepitelne neoplazije su:
- Nejednakost u obliku i veličini ćelija i jedara,
- Poremećaj sazrevanja,
- Poremećaj odnosa citoplazma - jedro
- Prisutnost mitoza.
S obzirom na debljinu zahvatanja višeslojnog pločastog epitela neoplastičkim procesom, razlikuju se tri stepena cervikalne intraepitelne neoplazije (CIN).[4]
- CIN I
Promene kod ovog tipa su najblaži oblik cervikalne intraepitelne neoplazije. Mereći od bazalne membrane, promene na ćelijama ne zahvataju više od 1/3 debljine epitela. U bazalnome sloju nalazi se mali broj mitoza, a atipične ćelije sa atipičnim jedrima su retke.
- CIN II
Ovaj oblik neoplazije je srednje teški poremećaj u kome su promene na ćelijama nešto izraženije i prisutne su u donje 2/3 epitela sluzokože mereći od bazalne membrane. Takođe postoji poremećaj u rasporedu i sazrevanju ćelija, uz vidljivu prisutnost nezrelih ćelija sa povećanim sadržajem hromatina. Sloj bazalnih ćelija je proširen i sadržava veći broj mitoza i veći broj ćelija atipičnog izgleda.
- CIN III
Ovo je najteži oblik displazije i karcinom in situ. U ovo stadijumu displastične ćelije nalaze se u više od 2/3 debljine epitela ili je zahvaćena cela debljina epitela. Prisutne su mnogobrojne mitoze i brojne ćelije sa izrazitim promenama na jedrima. Znaci sazrevanja i diferencijacije epitela nalaze se samo u gornjoj trećini epitela.
Uporedni sistem klasifikacije premalignih promena grlića materice
| Displazija Karcinom in situ |
CIN Cervikalnaintraepitelna neoplazija |
SIL Skvamoznaintraepitelna lezija |
Posledice | Histološki nalaz |
|---|---|---|---|---|
| Normalni izgled skvamoznog epitela grlića (cerviksa) materice |
||||
| Displazija lakog stepena | L-SIL (Low-grade SIL/SIL niskog stepena) | |||
| Displazija srednjeg stepena | H-SIL (High-grade SIL/SIL visokog stepena) | Prethodi većini invazivnih formi planocelularnog karcinoma |
||
| Displazija teškog stepena | H-SIL (High-grade SIL/SIL visokog stepena) | Prethodi većini invazivnih formi planocelularnog karcinoma |
Dijagnoza se postavlja na osnovu:
Terapija[uredi | uredi kod]

U terapiji cervikalne intraepitelne neoplazija (CIN) uglavnom se koriste hirurške metode, u obliku lokalno destruktivnih ili ekscizijskih metoda, koje se primenjuju u ambulantnim ili bolničkim uslovima. Primarni cilj lečenja je da se u potpunosti odstrane i unište ćelije atipičnog epitela.
Hirurška terapija[uredi | uredi kod]
| Ablativne tehnike - metode | Ekscizione tehnike - metode |
|---|---|
|
|
- Lokalne destruktivne (ablativne) metode
Od lokalno destruktivnih metoda najčešće se koriste: krioterapija, laserska vaporizacija, radikalna dijatermija i hladna koagulacija. Iako se lokalno destruktivne metode bolje podnose i imaju manje komplikacija, njihov glavni nedostatak u odnosu na ekscizijske metode je nemogućnost uzimanja uzorka tkiva za patohistološku analizu.[1]
Lokalno destruktivne metode mogu se koristiti ako je kolposkopija zadovoljavajuća, tj. ako se u potpunosti prikaže zona transformacije, ako ne postoji sumnja na mikroinvazivnu ili invazivnu bolest, kao i ako ne postoji sumnja na žljezdanu bolest.
- Ekscizione metode
Ekscizione metode su obavezne ukoliko se kolposkopski ne može u celosti prikazati zona transformacije ili ukoliko postoji sumnja na invazivnu i žlezdanu bolest. Od ekscizijskih metoda danas se najčešće koriste laserska konizacija i LLETZ (engl. large loop excision of the transformation zone).
Indikacije za ekscizione metode su:
- Ako lezija zahvata endocervikalne kanal
- Ukoliko postoje velike, kompleksne lezije
- Kod nezadovoljavajućeg nalaza (skvamokolumnarna granica nije dostupna pregledu)
- Ako ne postoji korelacija između citologije i kolposkopije
- U slučaju rekurentne bolesti
Laserska konizacija se najčešće izvodi u lokalnoj anesteziji uz pomoć laserskih zraka koji istovremeno režu i koagulišu tako da je nakon intervencije krvarenje minimalno. Glavni nedostatak ove metode je moguće termičko oštećenje tkiva zbog čega bi bila nemoguća analiza ivica promene.
Danas se sve češće u kliničkoj praksi koristi najpoštedniji (najmanje invazivni) dijagnostičko-terapijski zahvat LLETZ koji se izvodi u lokalnoj anesteziji. Ova metoda koristi elektrodijatermijsku petlju koja istovremeno reže i koaguliše tkivo, i zato daje odličnu hemostazu. Za razliku od laserske konizacije, termička oštećenja su minimalna i ne utiču značajno na patohistološku analizu ivica promene.[15]
- Postintervenciono praćenje bolesnice
Nezavisno od rizika za rezidualnu ili rekurentnu intraepitelnu bolest, sve žene koje su lečene zbog CIN-a imaju pet puta veći rizik za nastatank invazivnog karcinoma nego opšta populacija i to nezavisno od metode kojom je rađena intervencija.[16] Zbog toga je obavezno praćenje svih žena, najmanje 10 godine posle tretmana. U prve dve godine on se sprovodi svakih šest meseci a nakon toga jednom godišnje. U slučaju atipije nalaza obavezna je patohistološka dijagnostika
Vidi još[uredi | uredi kod]
Izvori[uredi | uredi kod]
- ↑ 1,0 1,1 1,2 1,3 Šimunić V. Ginekologija. 2. izd. Zagreb: Naklada Ljevak; 2001.
- ↑ Vitković L, Mijović M, Trajković G, Jakovljević S. Histološko-citološka korelacija nalaza ipouzdanost papanicolau testa u otkrivanju premalignih i malignih promena na grlićumaternice. Praxis Medica. 2015;44:23–31.
- ↑ Junquiera LC. Osnove histologije. 10. izd. Zagreb: Školska knjiga; 2005.
- ↑ 4,0 4,1 Damjanov I, Jukić S, Nola M. Patologija. 3.izd. Zagreb: Medicinska naklada; 2011.
- ↑ Stanley M. Pathology and epidemiology of HPV infection in females. Gynecol Oncol.2010;117:5-10
- ↑ Moscicki AB. Impact of HPV infection in adolescent populations. J Adoles Health. 2005;37:3-9
- ↑ 7,0 7,1 7,2 7,3 Choi YJ, Park JS. Clinical significance of human papilloma virus genotyping. J GynecolOncol. 2016;27:e21.
- ↑ Parkin DM, Bray F. The burden of HPV-related cancers. Vaccine. 2006;24:11–25.
- ↑ Martin-Hirsch PPL, Paraskevaidis E, Bryant A, Dickinson HO. Surgery for cervical intraepithelial neoplasia. Cochrane Database Syst Rev. 2010;16:CD001318
- ↑ Park IU, Wojtal N, Silverberg MJ, Bauer HM, Hurley LB, Manos M. Cytology and HumanPapillomavirus Co-Test Results Preceding Incident High-Grade Cervical IntraepithelialNeoplasia. PLoS One. 2015;880:1–10.
- ↑ de Sanjose S, Quint WG, Alemany L. Human papillomavirus genotype attribution ininvasive cervical cancer: a retrospective cross-sectional worldwide study. Lancet Oncol2010;11:1048-56.
- ↑ Popović-Lazić J. Histološka slika cervikalnih intraepitelnih neoplazija. Dijagnostika i lečenje oboljenja cerviksa, vagine i vulve. Kolposkopski atlas. Elit-Medica. 2006;23-6.
- ↑ Grade N, Cortecchia S, Galanti G, Sgadari C, Costa S, Lillo M. Follow-up study of patientswith cervical intraepithelial neoplasia grade 1 overexpressing p16Ink4a. Int J GynecolCancer. 2013;23:1663–9.
- ↑ Vrdoljak-Mozetič D. Papa test danas - nova, Bethesda klasifikacija. Medix. 2005;11:85-9
- ↑ Martin-Hirsch PPL, Paraskevaidis E, Bryant A, Dickinson HO. Surgery for cervical intraepithelial neoplasia. Cochrane Database Syst Rev. 2010;16:CD001318.
- ↑ W.P Soutter, A de Barros Lopes, A Fletcher et al. Invasive cervical cancer after conservative therapy for cervical intraepithelial neoplasia. Lancet, 1997; 349:978– 980