Elektronska konfiguracija
Elektronska konfiguracija elementa je raspored elektrona koji pripadaju atomu datog elementa na njegovim elektronskim orbitalama.
Elektronska konfiguracija se utvrđuje na osnovu spetroskopskih ispitivanja i uz pomoć teoretskih proračuna. Kod mnogih elemenata, posebno lantanoida i prelaznih metala, postoje nesuglasice oko njihove elektronske konfiguracije.
Način zapisa konfiguracije[uredi | uredi kod]
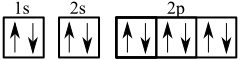
Elektronska konfiguracija se zapisuje na određen način.Taj zapis može da izgleda na primer ovako:
- neon: 1s22s22p6
ili ovako:
Brojevi koji se javljaju ispred slova označavaju energetske nivoe. Njihova numerizacija počinje od orbitale najbliže jezgru i raste sa odaljavanjem od njega. Mala slova ("s", "p", "d" i "f") označavaju vrste orbitala, a gornji brojevni indeksi označavaju broj elektrona koji se nalaze na datoj orbitali.
Za uprošćavanje elektronske konfiguracije često se stavlja skraćeni zapis. Npr:
ili:
- C: [He]2s22p2
gdje je [He] (helijum) - elektronska konfiguracija helija
Opšta pravila uspostavljanja konfiguracije[uredi | uredi kod]
- Prvo se popunjava orbitala "s", zatim "p", zatim "d", pa "f" i na kraju "g".
- Orbitale na višim energetskim nivoima popunjavaju se tek kad se popune niži energetski nivoi.
- Na orbitali s mogu da budu samo 2 elektrona, na p 6, na d 10, na f 14, na g 18.
- Na prvom energetskom nivou postoji samo orbitala s, na drugom energetskom nivou orbitale s i p, na trećem orbitale s, p i d i od četvrtog orbitale s, p, d i f. Od petog energetskog nivoa treba da se pojavljuje i orbitala g, ali svi trenutno poznati atomi mogu se opisati pomoću prve četiri orbitale.