Zakon održanja mase – razlika između verzija
Nema sažetka izmjene |
Nema sažetka izmjene |
||
| Red 9: | Red 9: | ||
== Istorija == |
== Istorija == |
||
{{Mehanika kontinuuma}} |
{{Mehanika kontinuuma}} |
||
Zakon održanja materije, jedan od najstarijih zakona fizike, formulisan je još u antičkoj Grčkoj, ali bez eksperimentalne potvrde. |
Zakon održanja materije, jedan od najstarijih zakona fizike, formulisan je još u antičkoj Grčkoj, ali bez eksperimentalne potvrde. |
||
| Red 22: | Red 21: | ||
Kako je [[Mihail Vasiljevič Lomonosov|Lomonosov]] formulisao sličnu pravilnost nešto ranije ([[1748]]. ili [[1756]]), zakon se ponekad zove i Lavoazje-Lomonosovljev zakon. |
Kako je [[Mihail Vasiljevič Lomonosov|Lomonosov]] formulisao sličnu pravilnost nešto ranije ([[1748]]. ili [[1756]]), zakon se ponekad zove i Lavoazje-Lomonosovljev zakon. |
||
Ovaj zakon može |
Ovaj zakon može se definisati: |
||
Ukupna masa supstanci koje ulaze u reakciju jednaka je ukupnoj masi proizvoda reakcije. |
Ukupna masa supstanci koje ulaze u reakciju jednaka je ukupnoj masi proizvoda reakcije. |
||
| Red 42: | Red 41: | ||
:'''E = mc<sup>2</sup>''' |
:'''E = mc<sup>2</sup>''' |
||
Drugim rečima, umesto dva fundimentalna zakona: zakona o održanju mase i zakona o držanju energije, postoji samo jedan princip. |
Drugim rečima, umesto dva fundimentalna zakona: zakona o održanju mase i zakona o držanju energije, postoji samo jedan princip. Međutim, pri bilo kojoj hemijskoj promeni praćenoj promenom temperature, desiće se i odgovarajuća promena mase. Po Ajnštajnovoj formuli, mora se dio ukupne mase ('''m''') reaktanata pretvoriti u energiju ('''''E''''') kemijske reakcije prema relaciji: '''''E = mc<sup>2</sup>''''', gdje je '''''c''''' [[brzina svjetlosti]] (2,997925• 10<sup>8</sup>ms<sup> -1</sup>). Odatle slijedi da bi točnost vaganja morala biti najmanje '''1:10<sup>10</sup>''' da bi se ustanovio gubitak mase. |
||
Međutim, pri bilo kojoj hemijskoj promeni praćenoj promenom temperature, desiće se i odgovarajuća promena mase. Po Ajnštajnovoj formuli, mora se dio ukupne mase ('''m''') reaktanata pretvoriti u energiju ('''''E''''') kemijske reakcije prema relaciji: '''''E = mc<sup>2</sup>''''', gdje je '''''c''''' [[brzina svjetlosti]] (2,997925• 10<sup>8</sup>ms<sup> -1</sup>). Odatle slijedi da bi točnost vaganja morala biti najmanje '''1:10<sup>10</sup>''' da bi se ustanovio gubitak mase. |
|||
== Literatura == |
== Literatura == |
||
| Red 50: | Red 47: | ||
{{DEFAULTSORT:Zakon o održanju mase}} |
{{DEFAULTSORT:Zakon o održanju mase}} |
||
{{Historija fizike}} |
|||
[[Kategorija:Fizički zakoni]] |
[[Kategorija:Fizički zakoni]] |
||
Verzija na datum 1 septembar 2020 u 14:48
Zakon održanja mase (ili zakon očuvanja mase) predstavlja eksperimentalno utvrđenu činjenicu da je u hemijskim reakcijama masa reaktanata jednaka masi proizvoda reakcije. S obzirom na to da u nuklearnim reakcijama i pri velikim brzinama (uporedivim sa brzinom svetlosti) dolazi do pretvaranja mase u energiju ili obrnuto, može se smatrati specijalnim slučajem zakona o održanju materije.
Površnim posmatranjem nekih procesa u prirodi (kao što su rast drveta, sagorevanje sveće ili isparavanje vode) može se doći do ubeđenja da materija može nastati i nestati. Međutim pažljivim posmartanjem može se utvrditi da ovo nije slučaj. Materija može da promeni svoj oblik, agregatno stanje i sl. ali ne može nastati ni iz čega ili nestati.
Ovaj zakon se ponekada i naziva zakon o neuništivosti materije, koji glasi: Materija se ne može uništiti, niti ni iz čega stvoriti, ona može samo da se menja i da prelazi iz jednog u drugi oblik.
Istorija
Zakon održanja materije, jedan od najstarijih zakona fizike, formulisan je još u antičkoj Grčkoj, ali bez eksperimentalne potvrde.
Otkriće zakona
A. L. Lavoazije (Lavoisier) je 1774. u eksperimentu u kome je zagrevao kalaj sa vazduhom u zatvorenom sudu primetio da je težina celog sistema ista pre i posle hemijske reakcije. Ovaj eksperiment je ukazao na činjenicu da nema pre i posle reakcije nema promene količine materije. Na osnovu svojih pokusa, Lavoazije je formulirao Zakon o održanju mase na sledeći način:
- Nikakve se promjene ne mogu opaziti u ukupnoj masi svih tvari koje sudjeluju u kemijskoj reakciji..
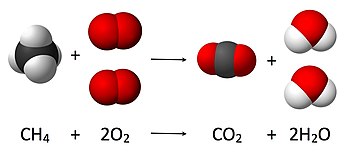
Na primjer, reakcija vodika s kisikom i nastanak vode:
Rezultat:
Kako je Lomonosov formulisao sličnu pravilnost nešto ranije (1748. ili 1756), zakon se ponekad zove i Lavoazje-Lomonosovljev zakon.
Ovaj zakon može se definisati:
Ukupna masa supstanci koje ulaze u reakciju jednaka je ukupnoj masi proizvoda reakcije. Ako A i B predstavljaju mase dveju supstanci koje učestvuju u nekoj hemijskoj reakciji pri kojoj nastaju mase C i D drugih dveju (hemijski promenjenih) supstanci, zakon o održanju mase se može izraziti kao:
A+B = C+D
Eksperimentalne potvrde
H. Landolt (1893) i A. Heydweiller (1901) su izvršili eksperimente da bi potvrdili tačnost ovog zakona. Hans Landolt (1831.-1910.), švicarski fizički kemičar, vrlo je preciznim mjerenjima potvrdio taj zakon s točnošću 1: 107.
J. J. Maley je 1912. godine upotrebio vagu koja je bila znatno usavršena da bi se otklonio nedostatak gore navedenih eksperimenata. On je uspeo da dokaže da u slučaju reakcije između barijumhlorida i natrijumsulfata, svaka promena u masi mora biti manja od jednog milionitog dela.
Teorija relativnosti
Prema Einsteinovoj teoriji relativnosti, materija (kao oblik energije) i energija mogu prelaziti jedna u drugu, u međusobnom odnosu koji je definisan poznatom Ajnštajnovom jednačinom:
- E = mc2
Drugim rečima, umesto dva fundimentalna zakona: zakona o održanju mase i zakona o držanju energije, postoji samo jedan princip. Međutim, pri bilo kojoj hemijskoj promeni praćenoj promenom temperature, desiće se i odgovarajuća promena mase. Po Ajnštajnovoj formuli, mora se dio ukupne mase (m) reaktanata pretvoriti u energiju (E) kemijske reakcije prema relaciji: E = mc2, gdje je c brzina svjetlosti (2,997925• 108ms -1). Odatle slijedi da bi točnost vaganja morala biti najmanje 1:1010 da bi se ustanovio gubitak mase.
Literatura
- Molerova moderna neorganska hemija, popravljeno izdanje G. D. Parkersa četrvto neizmenjeno izdanje, Naučna knjiga, Beograd 197



