Metan – razlika između verzija
m Bot: popravljanje preusmjeravanja |
Nema sažetka izmjene |
||
| Red 1: | Red 1: | ||
{{chembox |
|||
{| {{prettyinfobox}} |
|||
| Watchedfields = changed |
|||
|+<font size="+1">'''Osobine'''</font> |
|||
| verifiedrevid = 268482465 |
|||
|- align=center |
|||
| ImageFileL1 = Methane-CRC-MW-dimensions-2D.png |
|||
| colspan=2 align=center | [[Datoteka:Methane-2D-stereo.svg|110px|Struktura metana]] |
|||
| ImageSizeL1 = 160px |
|||
| ImageFileR1 = Methane-CRC-MW-3D-balls.png |
|||
| ImageSizeR1 = 100px |
|||
| ImageFileL2 = Methane-3D-space-filling.svg |
|||
| ImageSizeL2 = 100px |
|||
| ImageFileR2 = Ch4-structure.png |
|||
| ImageSizeR2 = 100px |
|||
| IUPACName = |
|||
| OtherNames = Metil hidrid, biogas |
|||
| Section1 = {{Chembox Identifiers |
|||
| Abbreviations = |
|||
| CASNo = 74-82-8 |
|||
| CASNo_Ref = {{cascite}} |
|||
| PubChem = 297 |
|||
| ChemSpiderID = 291 |
|||
| SMILES = C |
|||
| InChI=1/CH4/h1H4 |
|||
}} |
|||
| Section2 = {{Chembox Properties |
|||
| Formula = CH<sub>4</sub><ref name="NIST">{{cite web |url=http://webbook.nist.gov/cgi/cbook.cgi?ID=C74828&Units=SI |title=NIST veb knjiga}}</ref> |
|||
| MolarMass = 16.042 g/mol |
|||
| Appearance = Bezbojni gas |
|||
| Density = 0.717 kg/m<sup>3</sup> (gas, 0 °C) <br/>415 kg/m<sup>3</sup> (tečnost) |
|||
| MeltingPtC = -182.5 |
|||
| BoilingPtC = -161.6 |
|||
| Solubility = 35 mg/L (17 °C) |
|||
| |
|||
}} |
|||
| Section7 = {{Chembox Hazards |
|||
| MainHazards = Visoko zapanjiv ('''F+''') |
|||
| NFPA-H = 1|NFPA-F = 4|NFPA-R = 0 |
|||
| RPhrases = {{R12}} |
|||
| SPhrases = {{(S2)}}, {{S9}}, {{S16}}, {{S33}} |
|||
| FlashPt = -188 °C |
|||
| Autoignition = |
|||
| ExploLimits = 5 – 15% <ref>{{cite web |url=http://www.airgas.com/documents/pdf/001033.pdf |title=MSDS Methane}}</ref> |
|||
}} |
|||
| Section8 = {{Chembox Related |
|||
| OtherFunctn = [[Etan]], [[propan]] |
|||
| Function = [[Alkani]]i |
|||
| OtherCpds = [[Metanol]], [[Hlorometan]], [[Mravlja kiselina]], [[formaldehid]], [[silan]] |
|||
}} |
|||
}} |
|||
'''Metan''' (CH<sub>4</sub>), poznat i kao blatni [[gas]] je najprostiji zasićeni [[ugljikovodici|ugljovodonik]] ([[alkani|alkan]]). Ukoliko vladaju [[normalni uslovi]] on je bezbojan gas. |
|||
U prirodi metan nastaje usled bezkiseoničnog raspada organskih materija (npr. na[[močvara]]ma). Metan je glavni sastojak [[zemni gas|zemnog gasa]]. Koristi se kao gas za grejanje i kao sirovina za dobijanje organskih [[hemijsko jedinjenje|jedinjenja]] |
|||
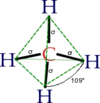
[[Molekula|Molekul]] metana ima oblik tetraedra. [[Atom]] [[ugljenik]]a s ima sp<sup>3</sup> [[hibridizacija|hibridizaciju]]. Ostale orbitale grade [[hemijska veza|hemijsku vezu]] sa četri atoma [[vodik|vodonika]]. Sve četri veze su podjednake (uglovi između veza iznose 109°28''<nowiki>'</nowiki>'') i veoma su malo polarizovane, što je zajedno sa nedostatkom slobodnih [[elektron]]skih parova velike postojanosti ovog jedinjenja. Metan može da učestvuje samo u [[hemijska reakcija|reakcijama]] tipičnim za [[alkani|alkane]] (npr: sagorevae). |
|||
Labaratorijski metan se dobija prženjem [[natrijum acetat]]a sa [[natrijum hidroksid]]om: |
|||
:CH<sub>3</sub>COONa + NaOH → CH<sub>4</sub> + Na<sub>2</sub>CO<sub>3</sub> |
|||
Druga metoda je [[hidroliza]] [[aluminijum karbid]]a: |
|||
:Al<sub>4</sub>C<sub>3</sub> +12H<sub>2</sub>O → 3CH<sub>4</sub> + 4Al(OH)<sub>3</sub> |
|||
==Osobine metana== |
|||
{| border="2" cellpadding="4" cellspacing="1" style="float: left; clear: left; margin: 1em 3em 1em 1em; border-collapse: collapse;" |
|||
<!--|+<font size="+1">''' '''</font>--> |
|||
|- |
|- |
||
| [[Kritična temperatura]] || 190,6 K (−82.6 °C)<br> 4.6 [[mega paskal|MPa]] |
|||
! colspan="2" align=center bgcolor="#FFDEAD" | '''Uopšteno''' |
|||
|- |
|- |
||
| [[Toplota fuzije|Δ<sub>fus</sub>''H'']] || 1,1 kJ/mol |
|||
| Ime || '''Metan''' |
|||
|- |
|- |
||
| [[Toplota isparavanja|Δ<sub>vap</sub>''H'']] || 8,17 kJ/mol |
|||
| [[Kemijska formula|Molekulska formula]] || [[Ugljenik|C]][[Vodik|H]]<sub>4</sub> |
|||
|- |
|||
| [[Molekulska masa]] || 16.04 [[jedinica atomske mase|u]] |
|||
|- |
|||
| Sinonimi || Metil hidrid |
|||
|- |
|||
| CAS broj || 74-82-8 |
|||
|- |
|||
! colspan="2" align="center" bgcolor="#FFDEAD" | '''Fazne karakteristike''' |
|||
|- |
|||
| [[Talište|Temperatura topljenja]] || 90.6 [[Kelvin|K]] (−182.5 [[Celzijus|°C]]) |
|||
|- |
|||
| [[Vrelište|Temperatura ključanja]] || 111.55 K (−161.6 °C) |
|||
|- |
|||
| [[Kritična temperatura]] || 190.6 K (−82.6 °C)<br /> 4.6 [[mega paskal|MPa]] |
|||
|- |
|||
| [[Toplota fuzije|Δ<sub>fus</sub>''H'']] || 1.1 kJ/mol |
|||
|- |
|||
| [[Toplota isparavanja|Δ<sub>vap</sub>''H'']] || 8.17 kJ/mol |
|||
|- |
|- |
||
! colspan="2" align="center" bgcolor="#FFDEAD" | '''Osobine gasa''' |
! colspan="2" align="center" bgcolor="#FFDEAD" | '''Osobine gasa''' |
||
|- |
|- |
||
| [[Standardna entalpija| |
| [[Standardna entalpija|Δ<sub>f</sub>H<sup>0</sup><sub>gas</sub>]] || −74,87 kJ/mol |
||
|- < |
|- < |
||
| [[Standardna molarna entropija|''S''<sup>0</sup><sub>gas</sub>]] || 188 J/( |
| [[Standardna molarna entropija|''S''<sup>0</sup><sub>gas</sub>]] || 188 J/(mol·K) |
||
|- |
|- |
||
| [[Toplotni kapacitet|''C''<sub>p</sub>]] || 35.69 J/( |
| [[Toplotni kapacitet|''C''<sub>p</sub>]] || 35.69 J/(mol·K) |
||
|- |
|- |
||
! colspan="2" align="center" bgcolor="#FFDEAD" | ''' |
! colspan="2" align="center" bgcolor="#FFDEAD" | '''Bebednost''' |
||
|- |
|- |
||
| [[Blještavost]] || −188 °C |
|||
| Hronični efekti || ??? |
|||
|- |
|||
| [[Blještavost]] || −188 °C |
|||
|- |
|- |
||
| Limit eksplozivnosti || 5-15% |
| Limit eksplozivnosti || 5-15% |
||
|- |
|- |
||
|} <!-- </font> --> |
|||
! colspan="2" align="center" bgcolor="#FFDEAD" | '''Više informacija''' |
|||
|- |
|||
| {{NFPA-chembox |H = 1|F = 4| R = 0| O = }} |
|||
|- |
|||
| Osobine || [http://webbook.nist.gov/cgi/cbook.cgi?ID=C74828&Units=SI NIST veb knjiga] |
|||
|- |
|||
! colspan="2" align="center" bgcolor="#FFDEAD" | <font size="-1"> Tamo gde drugačije nije naglašeno upotrebljene su [[SI]] jedinice i [[normalni uslovi]].</font> |
|||
|} |
|||
[[Datoteka:Methane-3D-space-filling.svg|thumb|left|molekul metana]] '''Metan''' (CH<sub>4</sub>), poznat i kao blatni [[gas]] je najprostiji zasićeni [[ugljikovodici|ugljovodonik]] ([[alkani|alkan]]). Ukoliko vladaju [[normalni uslovi]] on je bezbojan gas. |
|||
U prirodi metan nastaje usled bezkiseoničnog raspada organskih materija (npr. na[[močvara]]ma). Metan je glavni sastojak [[zemni gas|zemnog gasa]]. Koristi se kao gas za grejanje i kao sirovina za dobijanje organskih [[hemijsko jedinjenje|jedinjenja]] |
|||
[[Molekula|Molekul]] metana ima oblik tetraedra. [[Atom]] [[ugljenik]]a s ima sp<sup>3</sup> [[hibridizacija|hibridizaciju]]. Ostale orbitale grade [[hemijska veza|hemijsku vezu]] sa četri atoma [[vodik|vodonika]]. Sve četri veze su podjednake (uglovi između veza iznose 109°28''<nowiki>'</nowiki>'') i veoma su malo polarizovane, što je zajedno sa nedostatkom slobodnih [[elektron]]skih parova velike postojanosti ovog jedinjenja. Metan može da učestvuje samo u [[hemijska reakcija|reakcijama]] tipičnim za [[alkani|alkane]] (npr: sagorevae). |
|||
Labaratorijski metan se dobija prženjem [[natrijum acetat]]a sa [[natrijum hidroksid]]om: |
|||
:CH<sub>3</sub>COONa + NaOH → CH<sub>4</sub> + Na<sub>2</sub>CO<sub>3</sub> |
|||
Druga metoda je [[hidroliza]] [[aluminijum karbid]]a: |
|||
:Al<sub>4</sub>C<sub>3</sub> +12H<sub>2</sub>O → 3CH<sub>4</sub> + 4Al(OH)<sub>3</sub> |
|||
Osobine metana: |
|||
* [[kritičan pritisak]] 46,3 bar |
* [[kritičan pritisak]] 46,3 bar |
||
* [[gustina]] 0,717 [[kilogram|kg]]/[[metar|m]]<sup>3</sup><sub>n</sub> |
* [[gustina]] 0,717 [[kilogram|kg]]/[[metar|m]]<sup>3</sup><sub>n</sub> |
||
| Red 75: | Red 94: | ||
Velike količine metana se nalaza na [[planeta]]ma u obliku mora (kao što na zemlji postoje mora vode, tako na nekim planetama postoje mora metana) |
Velike količine metana se nalaza na [[planeta]]ma u obliku mora (kao što na zemlji postoje mora vode, tako na nekim planetama postoje mora metana) |
||
{{clear-left}} |
|||
== Izvori == |
|||
{{alkani}} |
|||
{{reflist|2}} |
|||
== Spoljašnje veze== |
|||
{{Portal|Hemija}} |
|||
{{Commonscat|Methane}} |
{{Commonscat|Methane}} |
||
{{alkani}} |
|||
{{Hidridi}} |
|||
[[Kategorija:Alkani]] |
[[Kategorija:Alkani]] |
||
Verzija na datum 11 april 2014 u 19:08
| Metan | |||
|---|---|---|---|
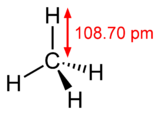 |
 | ||
 |
 | ||
| Drugi nazivi | Metil hidrid, biogas | ||
| Identifikacija | |||
| CAS registarski broj | 74-82-8 | ||
| PubChem[1][2] | 297 | ||
| ChemSpider[3] | 291 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | CH4[4] | ||
| Molarna masa | 16.042 g/mol | ||
| Agregatno stanje | Bezbojni gas | ||
| Gustina | 0.717 kg/m3 (gas, 0 °C) 415 kg/m3 (tečnost) | ||
| Tačka topljenja |
-182.5 °C, 91 K, -297 °F | ||
| Tačka ključanja |
-161.6 °C, 112 K, -259 °F | ||
| Rastvorljivost u vodi | 35 mg/L (17 °C) | ||
| Opasnost | |||
| Opasnost u toku rada | Visoko zapanjiv (F+) | ||
| NFPA 704 | |||
| R-oznake | R12 | ||
| S-oznake | S2, S9, S16, S33 | ||
| Tačka paljenja | -188 °C | ||
| Eksplozivni limiti | 5 – 15% [5] | ||
| Srodna jedinjenja | |||
| Srodna Alkanii | Etan, propan | ||
| Сродна једињења | Metanol, Hlorometan, Mravlja kiselina, formaldehid, silan | ||
|
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Metan (CH4), poznat i kao blatni gas je najprostiji zasićeni ugljovodonik (alkan). Ukoliko vladaju normalni uslovi on je bezbojan gas.
U prirodi metan nastaje usled bezkiseoničnog raspada organskih materija (npr. namočvarama). Metan je glavni sastojak zemnog gasa. Koristi se kao gas za grejanje i kao sirovina za dobijanje organskih jedinjenja
Molekul metana ima oblik tetraedra. Atom ugljenika s ima sp3 hibridizaciju. Ostale orbitale grade hemijsku vezu sa četri atoma vodonika. Sve četri veze su podjednake (uglovi između veza iznose 109°28') i veoma su malo polarizovane, što je zajedno sa nedostatkom slobodnih elektronskih parova velike postojanosti ovog jedinjenja. Metan može da učestvuje samo u reakcijama tipičnim za alkane (npr: sagorevae).
Labaratorijski metan se dobija prženjem natrijum acetata sa natrijum hidroksidom:
- CH3COONa + NaOH → CH4 + Na2CO3
Druga metoda je hidroliza aluminijum karbida:
- Al4C3 +12H2O → 3CH4 + 4Al(OH)3
Osobine metana
| Kritična temperatura | 190,6 K (−82.6 °C) 4.6 MPa |
| ΔfusH | 1,1 kJ/mol |
| ΔvapH | 8,17 kJ/mol |
| Osobine gasa | |
|---|---|
| ΔfH0gas | −74,87 kJ/mol |
| S0gas | 188 J/(mol·K) |
| Cp | 35.69 J/(mol·K) |
| Bebednost | |
| Blještavost | −188 °C |
| Limit eksplozivnosti | 5-15% |
- kritičan pritisak 46,3 bar
- gustina 0,717 kg/m3n
- toplota sagorevanja 13 264 kcal/kg = 55,53 MJ/kg
Mešavina metana sa vazduhom u razmeri 1:10 ima eksplozivno dejstvo. Nastanak ovakve smeše u rudnicima je često razlog velikih eksplozija i smrti mnogih ljudi.
Velike količine metana se nalaza na planetama u obliku mora (kao što na zemlji postoje mora vode, tako na nekim planetama postoje mora metana)
Izvori
- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519.
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846.
- ↑ „NIST veb knjiga”.
- ↑ „MSDS Methane”.

