Metan – razlika između verzija
m razne ispravke |
Nema sažetka izmjene |
||
| Red 7: | Red 7: | ||
|- |
|- |
||
| Ime || '''Metan''' |
| Ime || '''Metan''' |
||
| ⚫ | |||
| colspan="2" align=center | <div style="float:center; border:1px; border-style:solid; padding:2px;"> |
|||
|- |
|- |
||
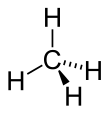
| [[Molekulska formula]] || [[Ugljenik|C]][[Vodonik|H]]<sub>4</sub> |
| [[Molekulska formula]] || [[Ugljenik|C]][[Vodonik|H]]<sub>4</sub> |
||
| Red 38: | Red 36: | ||
| [[Toplotni kapacitet|''C''<sub>p</sub>]] || 35.69 J/(mol•K) |
| [[Toplotni kapacitet|''C''<sub>p</sub>]] || 35.69 J/(mol•K) |
||
|- |
|- |
||
! colspan="2" align="center" bgcolor="#FFDEAD" | ''' |
! colspan="2" align="center" bgcolor="#FFDEAD" | '''Bezbednost''' |
||
|- |
|- |
||
| Hronični efekti || ??? |
| Hronični efekti || ??? |
||
| Red 47: | Red 45: | ||
|- |
|- |
||
! colspan="2" align="center" bgcolor="#FFDEAD" | '''Više informacija''' |
! colspan="2" align="center" bgcolor="#FFDEAD" | '''Više informacija''' |
||
| ⚫ | |||
| {{NFPA-chembox |H = 1|F = 4| R = 0| O = }} |
|||
|- |
|- |
||
| Osobine || [http://webbook.nist.gov/cgi/cbook.cgi?ID=C74828&Units=SI NIST veb knjiga] |
| Osobine || [http://webbook.nist.gov/cgi/cbook.cgi?ID=C74828&Units=SI NIST veb knjiga] |
||
Verzija na datum 11 juli 2012 u 19:11
| |
| Uopšteno | |
|---|---|
| Ime | Metan |
| Molekulska formula | CH4 |
| Molekulska masa | 16.04 u |
| Sinonimi | Metil hidrid |
| CAS broj | 74-82-8 |
| Fazne karakteristike | |
| Temperatura topljenja | 90.6 K (−182.5 °C) |
| Temperatura ključanja | 111.55 K (−161.6 °C) |
| Kritična temperatura | 190.6 K (−82.6 °C) 4.6 MPa |
| ΔfusH | 1.1 kJ/mol |
| ΔvapH | 8.17 kJ/mol |
| Osobine gasa | |
| ΔfH0gas | −74.87 kJ/mol |
| S0gas | 188 J/(mol•K) |
| Cp | 35.69 J/(mol•K) |
| Bezbednost | |
| Hronični efekti | ??? |
| Blještavost | −188 °C |
| Limit eksplozivnosti | 5-15% |
| Više informacija | |
| NFPA 704 | |
| Osobine | NIST veb knjiga |
| Tamo gde drugačije nije naglašeno upotrebljene su SI jedinice i normalni uslovi. | |
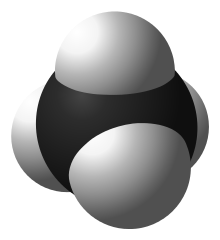
Metan (CH4), poznat i kao blatni gas je najprostiji zasićeni ugljovodonik (alkan). Ukoliko vladaju normalni uslovi on je bezbojan gas.
U prirodi metan nastaje usled bezkiseoničnog raspada organskih materija (npr. namočvarama). Metan je glavni sastojak zemnog gasa. Koristi se kao gas za grejanje i kao sirovina za dobijanje organskih jedinjenja
Molekul metana ima oblik tetraedra. Atom ugljenika s ima sp3 hibridizaciju. Ostale orbitale grade hemijsku vezu sa četri atoma vodonika. Sve četri veze su podjednake (uglovi između veza iznose 109°28') i veoma su malo polarizovane, što je zajedno sa nedostatkom slobodnih elektronskih parova velike postojanosti ovog jedinjenja. Metan može da učestvuje samo u reakcijama tipičnim za alkane (npr: sagorevae).
Labaratorijski metan se dobija prženjem natrijum acetata sa natrijum hidroksidom:
- CH3COONa + NaOH → CH4 + Na2CO3
Druga metoda je hidroliza aluminijum karbida:
- Al4C3 +12H2O → 3CH4 + 4Al(OH)3
Osobine metana:
- kritičan pritisak 46,3 bar
- gustina 0,717 kg/m3n
- toplota sagorevanja 13 264 kcal/kg = 55,53 MJ/kg
Mešavina metana sa vazduhom u razmeri 1:10 ima eksplozivno dejstvo. Nastanak ovakve smeše u rudnicima je često razlog velikih eksplozija i smrti mnogih ljudi.
Velike količine metana se nalaza na planetama u obliku mora (kao što na zemlji postoje mora vode, tako na nekim planetama postoje mora metana)

