Alfa heliks
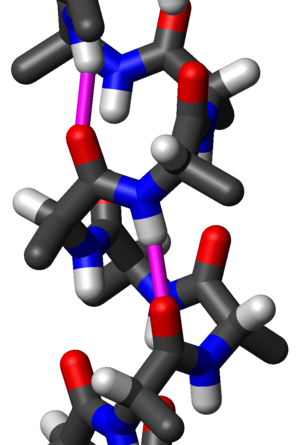
Čest motiv sekundarne strukture proteina, alfa heliks (α-heliks) je desnogira zavojita konformacija koja podseća na oprugu, kod koje svaka alfa-amino (N–H) grupa stvara vodoničnu vezu sa alfa-karbosilnom (C=O) grupom aminokiseline 4 ostatka ranije ( vodonična veza).
Polipeptidni lanac može formirati različite vrste heliksa koje se razlikuju po broju uvijanja lanca i po razmaku između uvijenih segmenata polipeptida u heliksu. One se obrazuju spontano, jer su energetski najsiromašnije, a time i najstabilnije konformacije proteina. Heliks mogu da obrazuju i L- i D-aminokiseline, ali samo jedne ili druge jer heliks ne može da se obrazuje od peptidnog lanca koji sadrži smešu ostataka L- i D-aminokiselina. Heliksi mogu biti desnogiri i levogiri, zavisno od toga na koju stranu se uvrće proteinski lanac; desnogiri heliks je određen pravcem u kome se okreću prsti desne ruke kada se palac postavi na osu heliksa u pravcu u kome se on gradi. L-aminokiseline su češće u prirodi i one mogu da obrazuju i levogiri i desnogiri heliks, ali većina poznatih heliksa u prirodi su desnogiri. Međutim, samo jedna heliksna konformacija istovremeno zadovoljava optimalne uslove uvijanja koja daje osnovu za lako uspostavljanje intramolekulskih vodoničnih veza između bliskih konstituenata peptidne veze. Ta forma se naziva α-heliks i najčešće je prisutna u proteinima živih sistema.
Razvoj teorije[uredi | uredi kod]
Tokom ranih 1930ih, Vilijem Estburi je uočio drastične promene u difrakciji Iks-zraka na vlaknima vlažne vune ili kose nakon primenjenog istezanja. Podaci su ukazivali na postojanje helikoidne molekulske strukture sa karakterističnim periodom ponavljanja od ~5,1 Å (0,51 nm). Estburi je pretpostavio sledeće: (1) neistegnuti molekuli proteina obrazuju heliks (koju je on nazvao α-oblik) i (2) istezanje dovodi do odmotavanja heliksa i stvaranja izduženog stanja (koje je nazvao β-oblik). Iako neprecizni u detaljima, Estburijevi modeli ovih struktura su bili suštinski ispravni i odgovaraju modernim elementima sekundarne strukture, α-heliksu i β-ravni (zadržana je Estburijeva nomenklatura), koje su razvili Linus Pauling, Robert Kouri i Herman Brenson 1951. godine. Hans Nojrat je prvi uočio da Estburijevi modeli ne mogu biti precizni do detalja, jer su podrazumevali preklapanje atoma. Interesantno, Nojratov rad i Estburijevi podaci su podstakli H. S. Tejlora, Morisa Haginsa, Brega i saradnike da predlože model keratina koji podseća na moderni α-heliks. Dva ključna koraka u razvoju i oblikovanju modernog α-heliksa bili su: (1) pravilna geometrija veze, opisana zahvaljujući metodama određivanja kristalne strukture amino kiselina i peptida kao i Paulingovim predviđanjima planarnih peptidnih veza i (2) odbacivanje ideje o obaveznom celom broju ostataka po punom obrtu heliksa. Ideja o osovinskom momentu se javila u januaru 1948, kada se Pauling prehladio i legao u krevet. Pošto mu je bilo dosadno, nartao je polipeptidni lanac približno tačnih dimenzija na papirnoj traci i savio je u heliks, pazeći da peptidne veze održi planarnim. Posle nekoliko pokušaja, napravio je model sa fizički verovatnim vodonočnim vezama. Zatim je nastavio rad na potvrđivanju tog modela sa Korijem i Brensonom pre objavljivanja.
Struktura[uredi | uredi kod]
Geometrija i vodonične veze[uredi | uredi kod]
Aminokiseline se, u alfa-heliksu, uređuju u desnogiru uvijenu (helikoidnu) strukturu široku 5,4 Å (0.54 nm). Svaka aminokiselina odgovara okretu u heliksu od 100° (tj. heliks ima 3,6 ostataka po punom krugu) i translaciju od 1,5 Å (0.15 nm) duž ose heliksa. Najvažnije, N–H grupa amino kiseline gradi vodoničnu vezu sa C=O grupom 4 amino kiseline niže niz lanac. Razlog za ovako uspostavljanje vodoničnih veza u α-heliksu je to što se tako postiže optimalno rastojanje od 2,8 Å između O- i N- atoma ovih grupa, pa bi se vodonične veze mogle formirati. Bočne grupe aminokiselina u α-heliksu su okrenute ka spoljašnosti heliksa što omogućava da se izbegne prostorna interferencija ovih grupa. α-heliks je uobičajeni element sekundarne strukture kako fibroznih, tako i globularnih proteina. U globularnim proteinima α-heliksa su izgrađene u proseku od 12 aminokiselina i dužine su oko 18 Å, mada su u pojedinim proteinima nađeni i α-heliksi izgrađeni od 53 aminokiselinska ostatka. Vodonične veze u α-heliksu su skoro paralelne sa uzdužnom osom. Za raskidanje vodoničnih veza potrebna je mala energija (svega 21-42 kJ/mol, skoro deset puta manje nego za raskidanje kovalentne veze), ali α-heliks predstavlja stabilnu strukturu, jer u formiranju vodoničnih veza učestvuje svaka peptidna veza, što ukupno zahteva značajnu energiju za destabilizaciju ove strukture. Ovo ponavljanje vodoničnih veza definiše α-heliks. Slične strukture imaju i 310 heliksa () i π-heliksa (). Ove alternativne zavojnice su relativno retke, iako se 310 heliks često nalazi na kraju α-heliksa, „zatvarajući“ je. Privremene strukture (ponekad obeležavane kao δ-heliksi) su primećene kao intermedijeri u simulacijama molekulske dinamike uvijanja α-heliksa.
A. K. ostaci α-heliksa zauzimaju osovinske (φ, ψ) diedarske uglove od približno (-60°, -45°). U opštem slučaju, oni zauzimaju diedarke uglove tako da se ψ diedarski ugao jedne aminokiseline i φ ugao sledećeg ostatka sabiraju do vrednosti od -105° približno. Shodno tome, diedarski uglovi α-heliksa se, uglavnom, smeštaju na dijagonalne trake Ramahandranovog dijagrama (sa padom -1), uzimajući vrednosti od (-90°, -15°) do (-35°, -70°). Poređenja radi, suma diedarskih uglova 310 heliksa je približno -75°, dok je kod π-heliksa ona -130°. Opšta formula za uglove rotacije Ω po ostatku bilo kojeg polipeptidnog helikoidnog lanca sa trans izomerima dobija se pomoću jednačine:
Alfa heliks je gusto pakovan; skoro da nema slobodnog prostora unutar njega. Bočni lanci aminokiselina se nalaze na spoljašnjoj strani i blago su povijeni „nadole“ (prema N-terminusu), kao grane zimzelenog drveta. Ova usmerenost se ponekad koristi pri preliminarnim mapama (sa niskom rezolucijom) elektronske gustine za određivanje smera uvijanja proteinske osovine.
Definicija ose heliksa[uredi | uredi kod]
Predloženo je nekoliko definicija osa heliksa, od kojih je Sugeta-Mijazavina najjednostavnija i najopštija. Sve definicije su ekvivalentne ako svaki ostatak heliksa ima istu geometriju veze i diedarske uglove. Ipak, definicije odlikuje različita osetljivost na promene ovih parametara.
Stabilnost[uredi | uredi kod]
Heliksi uključeni u strukturu proteina mogu biti građeni od 4 do 40 aminokiselina, ali je tipičan heliks građen od 10 aminokiselina (oko tri kruga). Kratki polipeptidi uglavnom ne grade alfa-helikse u rastvoru, pošto entropijski utrošak energije uložen za uvijanje polipeptidnog lanca nije kompenzovan dovoljnim brojem stabilizujićih interakcija. Vodonične veze osnovne strukture α-heliksa se uglavnom smatraju slabijim od onih kod β-ravni i izložene su jakom dejstvu molekula vode, kao rastvarača. Sa druge strane, u nešto hidrofobnijim sredinama (kao što je ćelijska membrana, ili u prisustvu drugih rastvarača kao trifluoroetanola (TFE)) oligopeptidi redovno formiraju stabilne α-helikoidne strukture.
Eksperimentalno određivanje[uredi | uredi kod]
Pošto je α-heliks definisan svojim vodoničnim vezama, najpouzdanije eksperimetalne metode određivanja α-heliksa, do rezolucije pojedinačnih atoma, su rentgenska kristalografija ili NMR spektroskopija. U nekim slučajevima, pojedine vodonične veze se mogu posmatrati direktno kao slaba skalarna sprezanja u NMR spektru.
Postoji nekoliko niskorezolutivnih metoda za određivanje opšte helikoidne strukture. Hemijski pomeraj u NMR (posebno Cα, Cβ i S’ atoma) i rezidualno dipolarno sprezanje su često karakteristike heliksa. Spektar cirkularnog dihrotoizma heliksa u dalekoj ULJ oblasti (170-250 nm) je veoma karakterističan, sa izraženim dvostrukim minimumom na ~208 nm i ~222 nm. Infracrvena spektroskopija se retko koristi, pošto spektar α-heliksa podseća na spektar nasumične zavojnice (doduše, spektri se mogu razlikovati, npr. pomoću vodonično-deuterijumske zamene). Konačno, krioskopska elektronska mikroskopija je danas u mogućnosti da razaznaje pojedinačne α-helikse unutar proteina, dok je primena ove metode na određivanje pojedinih ostataka još predmet istraživanja.
Dugi homopolimeri amino kiselina, ako su rastvorljivi, često grade helikse. Takvi dugi, izolovani heliksi mogu se detektovati drugim metodama, kao što su dielektrična relaksacija, ili hidrodinamička tehnika za merenje rotacionih difuzionih konstanti. Strogo govoreći, ove metode samo detektuju karakteristični prolatni (duguljasti), hidrodinamični oblik heliksa, ili njegov veliki dipolni moment.
Zastupljenost aminokiselina i njihov afinitet prema α-heliksu[uredi | uredi kod]
Različite sekvence aminokiselina imaju različite afinitete za formiranje α-helikalne strukture. Metionin, alanin, leucin, glutaminska kiselina i lizin ("MALEK" u jednoslovnim kodovima aminokiselina) imaju veoma visoke afinitete prema α-heliksu. Prolin teži da raskine ili uvrne heliks, pošto ne može da donira proton za vodoničnu vezu (jer nema amidni vodonikov atom) i zato što njegov bočni lanac sterno interaguje. NJegova prstenasta struktura takođe ograničava centralni φ diedarski ugao na vrednosti oko -70°, što se retko viđa kod α-heliksa. Ipak, prolin je često prvi član heliksa, verovatno zbog svoje strukturne krutosti. Sa druge strane, glicin takođe teži da poremeti helikalnu strukturu, zato što ga visoka konformaciona fleksibilnost čini entropijski prejakim da zauzme relativno sputanu α-helikalnu strukturu.
Dipolni moment[uredi | uredi kod]
Heliks ima merljiv ukupan dipolni moment izazvan efektom nagomilavanja pojedinačnih dipola karbonilnih grupa peptidne veze duž ose. Ova pojava može dovesti do destabilizacije heliksa kroz entropijske efekte. Kao rezultat, α-heliksi često počinju na N-terminalnom kraju sa negativno naelektrisanom aminokiselinom, kao što je glutaminska kiselina, kako bi se neutralisao ovaj dipolni moment heliksa. Ređe (i manje efektivno) je završavanje lanca na S-kraju sa aminokiselinom sa pozitivnim ostatkom, kao što je lizin. Pozitivan naboj na N-terminusu se uglavnom koristi da veže negativno naelektrisane ligande, kao što su fosfatne grupe, što je veoma efikasno, jer amidi primarne strukture mogu da služe kao donori protona vodonične veze.
Superstrukture[uredi | uredi kod]
Mioglobin, prvi protein čija je struktura određena rendgenskom kristalografijom, sastavljen je od približno 70% alfa heliksa, pri čemu ostatak čine oblasti neuređenih krivina.
Upredene zavojnice alfa heliksa su veoma stabilni oblici u kojima se dve ili više heliksa međusobno upliću u „superhelikalnu“ strukturu. Upredene zavojnice imaju veoma karakterističan ponavljajući motiv poznat kao heptadni ostatak, u kojem se osnovni motiv ponavlja svakih sedam aminokiselina duž niza. Prva i posebno četvrta aminokiselina (na tzv. a i h mestima) su skoro uvek hidrofobne (četvrta a. k. je obično leucin) i gusto pakovane unutar namotaja heliksa. Peti i sedmi ostatak (na e i g mestima), uglavnom imaju suprotna naelektrisanja i grade jonski most stabilizovan elektrostatičkim interakcijama. Fibrozni proteini, kao keratin i miozin, često grade upredene zavojnice, kao i neki dimerizujući proteini. Par upredenih zavojnica – namotaj od 4 heliksa – je veoma čest strukturni motiv u proteinima. Npr. nalazi se u strukturi hormona rasta čoveka i nekoliko varijeteta citohroma. Ropov protein, koji ubrzava umnožavanje plazmida u bakterijama je zanimljiv slučaj u kojem jedan polipeptid formira upredenu zavojnicu, a dva takva monomera se spajaju dajući namotaj od 4 heliksa.
Aminokiseline koje grade dati heliks mogu se prikazati na heličnom točku, prikazu koji ilustruje orijentaciju aminokiselina koje grade heliks. Često u globularnim proteinima, kao i u posebnim strukturama poput upredene zavojnice i leucinskog rajsferšlusa, alfa heliks će ispoljiti dva „lica“ – jedno, koje prvenstveno sadrži hidrofobnu aminokiselinu, orijentisanu ka unutrašnjosti proteina, ka hidrofobnom jezgru; i drugo, koje je uglavnom sastavljeno od polarnih aminokiselina, orijentisanih ka površini proteina izloženoj rastvaraču.
Funkcionalne uloge[uredi | uredi kod]
α-heliksi imaju poseban značaj u strukturama koje učestvuju u metabolizmu DNK, uključujući motive tipa heliks-okret-heliks, leucinski rajsferšlus i cink-prst. Sve to, zbog zgodne strukturne osobine da je prečnik α-heliksa 1,2 nanometra, isti kao i širina velikog žljeba u B-obliku DNK.
Prelaz iz heliksa u zavojnicu[uredi | uredi kod]
Homopolimeri aminokiselina (kao poli-lizin) mogu da usvoje α-helikalnu strukturu na niskim temperaturama, koja se „topi“, razmotava, na višoj. Ovaj prelaz iz heliksa u zavojnicu se ranije smatrao analognim denaturaciji proteina. Statistička mehanika ovog prelaza se može modelovati korišćenjem elegantne metode matrice prelaza, koju karakterišu dva parametra: sklonost ka uvijanju heliksa i sklonost ka rastezanju iste.
Literatura[uredi | uredi kod]
- Carl Branden and John Tooze. 1999. Introduction to Protein Structure 2nd ed. Garland Publishing: New York, NY.
- David Eisenberg, "The discovery of the α-helix and β-sheet, the principal structural features of proteins". Proceedings of the National Academy of Sciences USA. (2003). 100:11207-11210. http://www.pnas.org/cgi/content/full/100/20/11207
- John Kendrew et al. 1960. The structure of myoglobin: a three-dimensional Fourier synthesis and 2Â resolution. Nature 185: 422-7.
- Astbury WT and Woods HJ. (1931) "The Molecular Weights of Proteins", Nature, 127, 663-665.
- Astbury WT and Street A. (1931) "X-ray studies of the structures of hair, wool and related fibres. I. General", Trans. R. Soc. Lond., A230, 75-101.
- Astbury WT. (1933) "Some Problems in the X-ray Analysis of the Structure of Animal Hairs and Other Protein Fibers", Trans. Faraday Soc., 29, 193-211.
- Astbury WT and Woods HJ. (1934) "X-ray studies of the structures of hair, wool and related fibres. II. The molecular structure and elastic properties of hair keratin", Trans. R. Soc. Lond., A232, 333-394.
- Astbury WT and Sisson WA. (1935) "X-ray studies of the structures of hair, wool and related fibres. III. The configuration of the keratin molecule and its orientation in the biological cell", Proc. R. Soc. Lond., A150, 533-551.
- Neurath H. (1940) "Intramolecular folding of polypeptide chains in relation to protein structure", J. Phys. Chem., 44, 296-305.
- Taylor HS. (1942) "Large molecules through atomic spectacles", Proc. Am. Philos. Soc., 85, 1-12.
- Huggins M. (1943) "The structure of fibrous proteins", Chem. Rev., 32, 195-218.
- Bragg L, Kendrew JC and Perutz MF. (1950) "Polypeptide chain configurations in crystalline proteins", Proc. Roy. Soc., A203, 321.
- Pauling L, Corey RB and Branson HR. (1951) "The Structure of Proteins: Two Hydrogen-Bonded Helical Configurations of the Polypeptide Chain", Proc. Nat. Acad. Sci. Wash., 37, 205.
- Sugeta H and Miyazawa T. (1967) "General Method for Calculating Helical Parameters of Polymer Chains from Bond Lengths, Bond Angles, and Internal-Rotation Angles", Biopolymers, 5, 673-679.
- Wada A. (1976) "The α-helix as an electric macro-dipole", Adv. Biophys., 9, 1-63.
- Chothia C, Levitt M and Richardson D. (1977) "Structure of proteins:Packing of α-helices and pleated sheets", Proceedings of the National Academy of Science USA, 74, 4130-4134.
- Chothia C, Levitt M and Richardson D. (1981) "Helix to Helix Packing in Proteins", Journal of Molecular Biology, 145, 215-250.
- Hol WGJ. (1985) "The role of the α-helix dipole in protein function and structure", Prog. Biophys. Mol. Biol., 45, 149-195.
- Barlow DJ and Thornton JM. (1988) "Helix Geometry in Proteins", J. Mol. Biol., 201, 601-619.
- Murzin AG and Finkelstein AV. (1988) "General architecture of the α-helical globule", Journal of Molecular Biology, 204, 249-269.




![{\displaystyle 3\cos \Omega =1-4\cos ^{2}\left[\left(\phi +\psi \right)/2\right]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/289a67463099a87877ac9fca00daf052bb2edd9a)