Natrijum nitrat
| Natrijum nitrat | |||
|---|---|---|---|
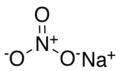 |
 | ||
| IUPAC ime |
| ||
| Drugi nazivi | Caliche Chile saltpeter Nitrate of soda Nitratine Peru saltpeter Soda niter | ||
| Identifikacija | |||
| CAS registarski broj | 7631-99-4 | ||
| PubChem[1][2] | 24268 | ||
| ChemSpider[3] | 22688 | ||
| UNII | 8M4L3H2ZVZ | ||
| UN broj | 1498 | ||
| ChEMBL[4] | CHEMBL1644698 | ||
| RTECS registarski broj toksičnosti | WC5600000 | ||
| Jmol-3D slike | Slika 1 | ||
| |||
| |||
| Svojstva | |||
| Molekulska formula | NaNO3 | ||
| Molarna masa | 84.9947 g/mol | ||
| Agregatno stanje | Beli prah ili bezbojni kristali | ||
| Gustina | 2.257 g/cm3 | ||
| Tačka topljenja |
308 °C | ||
| Tačka ključanja |
380 °C razlaže se | ||
| Rastvorljivost u vodi | 73 g/100 mL (0 °C) 92.1 g/100 ml (25 °C) 180 g/100mL (100 °C) | ||
| Rastvorljivost | veoma rastvoran u amonijaku; rastvoran u alkoholu | ||
| Indeks prelamanja (nD) | 1.587 (trigonalni) 1.336 (romobohedralni) | ||
| Struktura | |||
| Kristalna rešetka/struktura | trigonalni i rombohedralni | ||
| Termohemija | |||
| Standardna entalpija stvaranja jedinjenja ΔfH |
−468 kJ/mol | ||
| Standardna molarna entropija S |
117 J mol−1 K−1 | ||
| Opasnost | |||
| Podaci o bezbednosti prilikom rukovanja (MSDS) | ICSC 0185 | ||
| EU-indeks | Nije listiran | ||
| Opasnost u toku rada | Oksidant, iritant | ||
| NFPA 704 | |||
| Tačka paljenja | ne-zapaljiv | ||
| LD50 | 3236 mg/kg | ||
| Srodna jedinjenja | |||
| Drugi anjoni | Natrijum nitrit | ||
| Drugi katjoni | Litijum nitrat Kalijum nitrat Rubidijum nitrat Cezijum nitrat | ||
| Srodna jedinjenja | Natrijum sulfat Natrijum hlorid | ||
|
Ukoliko nije drugačije napomenuto, podaci se odnose na standardno stanje (25 °C, 100 kPa) materijala | |||
| Infobox references | |||
Natrijum nitrat NaNO3 je važan nitrat koji se javla u prirodi.[5] Najveća nalazišta su u Čileu, pa se zato naziva čileanska šalitra. Manjih nalazišta ima u Egiptu, Maloj Aziji, Kolumbiji i Kaliforniji, ali od tehničkog značaja su samo nalazišta u Čileu.
Dobijanje[uredi | uredi kod]
Sirova čilska šalitra većinom nije čista, nego se javlja sa pijeskom i glinom, te raznim drugim solima (najčešće natrijum hloridom). Osim toga sadrži primese natrijum-, magnezijum- i kalcijum- sulfata i malim količinama kalcijum jodata, te je siva ili smeđa kamena masa. Iz ovog materijala dobija se natrijum nitrat izluživanjem vrućom vodom. Pritom se nastali rastvor natrijum nitrata filtrira da se odvoji glineni mulj i zaostali nerastvoreni natrijum hlorid, a zatim se hladi pri čemu kristalizira. Dobiveni natrijum nitrat je 98%-tan. Matični lugovi sadrže natrijum jodat i služe za dobijanje joda.[6] U Njemačkoj se natrijum nitrat dobija pretežno iz sode sa azotnom kiselinom:
Na2CO3 + 2 HNO3 → 2 NaNO3 + H2O + CO2
i to tako da se nitrozni otpadni plinovi od oksidacije amonijaka apsorbiraju u rastvoru sode. Pritom nastali rastvor nitrita i nitrata (Na2CO3 + 2 NO2 → NaNO2 + NaNO3 + CO2) se zakiseli azotnom kiselinom i oksidira se u vazduju u nitrat, koji se sodom neutrališe i upari u vakuumskim isparivačima.
Osobine[uredi | uredi kod]
Natrijum nitrat kristalizira iz vodenog rastvora u obliku bezbojnih, kockastih romboedara (kubična šalitra), koji imaju tačku topljenja na 307 °C, a kod 380 °C počinju da se degradiraju. U vodi se lako rastvara i rastvorljivost mu jako raste sa porastom temperature.[7]
Upotreba[uredi | uredi kod]
Veći deo čilske šalitre ranije se koristio za đubrivo, ostali dio se upotrebljavao za dobijanje azotne kiseline i kalijumove šalitre. Danas natrijum-nitrat ima značaj samo kao veštačko đubrivo.
Reference[uredi | uredi kod]
- ↑ Li Q, Cheng T, Wang Y, Bryant SH (2010). „PubChem as a public resource for drug discovery.”. Drug Discov Today 15 (23-24): 1052-7. DOI:10.1016/j.drudis.2010.10.003. PMID 20970519.
- ↑ Evan E. Bolton, Yanli Wang, Paul A. Thiessen, Stephen H. Bryant (2008). „Chapter 12 PubChem: Integrated Platform of Small Molecules and Biological Activities”. Annual Reports in Computational Chemistry 4: 217-241. DOI:10.1016/S1574-1400(08)00012-1.
- ↑ Hettne KM, Williams AJ, van Mulligen EM, Kleinjans J, Tkachenko V, Kors JA. (2010). „Automatic vs. manual curation of a multi-source chemical dictionary: the impact on text mining”. J Cheminform 2 (1): 3. DOI:10.1186/1758-2946-2-3. PMID 20331846.
- ↑ Gaulton A, Bellis LJ, Bento AP, Chambers J, Davies M, Hersey A, Light Y, McGlinchey S, Michalovich D, Al-Lazikani B, Overington JP. (2012). „ChEMBL: a large-scale bioactivity database for drug discovery”. Nucleic Acids Res 40 (Database issue): D1100-7. DOI:10.1093/nar/gkr777. PMID 21948594.
- ↑ Housecroft C. E., Sharpe A. G. (2008). Inorganic Chemistry (3rd izd.). Prentice Hall. ISBN 978-0-13-175553-6.
- ↑ Parkes, G.D. & Phil, D. (1973). Melorova moderna neorganska hemija. Beograd: Naučna knjiga.
- ↑ Lide David R., ur. (2006). CRC Handbook of Chemistry and Physics (87th izd.). Boca Raton, FL: CRC Press. 0-8493-0487-3.
