Alotropska modifikacija

Alotropska modifikacija ili alotropija je pojava da se ista stvar javlja u više strukturnih oblika koji se razlikuju po fizičkim i/ili hemijskim svojstvima. Alotropi su dva ili više oblika istog hemijskog elementa koja se međusobno razlikuju po načinu međusobnog vezivanja atoma. Zbog različitih hemijskih veza alotropi imaju različita fizikalna i kemijska svojstva. Alotropija se odnosi na elementarne tvari, dok slična polimorfija samo na spojeve.[1][2]
Primjeri alotropije[uredi | uredi kod]
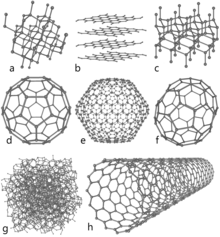
Za primjer alotropske modifikacije najčešće se spominje ugljik - C. Njegove alotropske modifikacije su dijamant, grafit, fuleren (C60).
Alotropske modifikacije između sebe su različite po svojstvima:
- dijamant je tvrd, proziran, visokog tališta i vrelišta, ne provodi struju (izolator), ali vodi toplinu; ne otapa se, kristalizira u plošno centriranoj elementarnoj ćeliji
- grafit provodi i struju i toplinu, mekan je, sive do crne boje, može sublimirati, topljiv u metalima, dolazi u obliku slojeva koji su povezani Van der Waalsovim silama, grafit je ujedno stabilniji od dijamanta jer sadrži manje energije, vidi entalpija.
- fuleren C60 je sličan dijamantu, izolator, može postati supravodljiv s dodatkom kalija, cezija ili rubidija.
Alotropske modifikacije su i kisik O2 i ozon O3 - (plavkast plin, u vodi slabo topljiv, najjači oksidans poslije fluora, dipol). Molekula kisika sadržava dva, a ozona tri atoma kisika. Zato običan kisik i ozon imaju različita fizikalna i kemijska svojstva.
Alotropske modifikacije ima i fosfor:
- bijeli fosfor - vrlo reaktivan, svjetluca u mraku (fosforescencija), otrov
- crveni fosfor - polimer, nije otrovan, ne fosforescira, nastaje iz bijelog fosfora na temperaturi od 260 °C.
- crni fosfor - umreženi polimer, nije otrovan, postoji samo pri visokom tlaku, nastaje od bijelog fosfora na visokoj temperaturi bez zraka.
Reference[uredi | uredi kod]
- ↑ Allotrope in IUPAC Compendium of Chemical Terminology, Electronic/ version, http://goldbook.iupac.org/A00243.html. Accessed March 2007.
- ↑ Housecroft C. E., Sharpe A. G. (2008). Inorganic Chemistry (3rd izd.). Prentice Hall. ISBN 978-0-13-175553-6.
Literatura[uredi | uredi kod]
- Ivan Filipović, Stjepan Lipanović: Opća i anorganska hemija, Školska knjiga, Zagreb, 1995.